| 第1章.まえがき、研究方法、関連事項 |
要約:慶應義塾大学解剖学教室 川村光毅
・構造と機能
・神経系の構造を研究する方法
・正常標本での研究
・古典的なニューロン説
・transmitterついて
・繊維結合の実験的研究の基礎

この本であつかわれている事項の理解を助けるために、神経系の種々の部分を取り扱う前に解剖学に関する一般的なことがらをいくつか考えてみよう。第一に神経系の解剖でわれわれが駆使できる方法、特に繊維の結合の研究方法についてざっとみておく必要がある。

| 構造と機能 |
解剖学は医学の基礎部分の1つであるが、それ自体では、機能との関連なくては不毛の学問である。なぜなら医学においてわれわれにとって興味のあるのは第一義的に機能であるから。器官や有機体の構造についての若干の知識を持っているということは、その機能を理解する上に必要かくべからざることである。事実、構造の知識はしばしば他のデータでは明らかにされない機能についての情報を与えるものである。構造上の差異が見い出されればそこにはまた機能的相違もある。その逆も又然りというのは現在殆ど原則(公理)として認められている。神経系で簡単な例をとれば、周知の如く、体性および内蔵性の遠心性の核を脳幹内に区別し得る。時には、構造上の差違が明らかでない場合があるが、これは、現在の方法をもってして微妙な差を描き出し得ないことによるのであろう。
神経学に於いて、構造上の特徴に関する知識は恐らく正常や病的状態の下での機能の理解にとって医学の他のいかなる分野におけるよりも重要である。神経系の疾病で生じる症状は多種多様であり、種々の機能や機能成分が含まれており、それ故に異なった構造物が侵されていることになる。臨床検査でわれわれは機能状態を分析し、どの程度に正常機能に変調を来しているかを理解しようと努める。神経解剖学のわれわれの知識が進めば進むほど、これらの機能的な障害や症状からその部分(構造物)が侵されているかを容易に推測することがでくる。しかしながら、局所的な診断学は、つまり侵された場所の決定は、ちょっと想像する程には、外科的処置が適用されるような場合に限っては、重要ではない。病因論etiological的診断、障害(病巣)の性質や原因の決定も又非常に重要であろう。神経系のある病気は選択的にある場合には専らある解剖学的および機能上のユニット(単位)のみを侵害し、一方他の症例では、病巣の局在は全く規則性がみられない。
したがって、病巣部位の決定は、病気の性質を理解する上に重要なlink(中間鎖)である。神経系の解剖に関するわれわれの知識がよりよくより詳しくなればなる程、われわれは臨床的知見をよりよく解釈でくるようになり、正確な診断により近づくことができるようになる。最初、無意味で理解しにく(ぼんやりとした)くみえる臨床的現象の詳細が、構造上のもって立つ所を広く知識としてもつことにより明白となり(理解しうるものとなり)価値のある情報を与えるようになるものである。

| 神経系の構造を研究する方法 |
神経系を研究した昔の解剖学者は、解剖(dissection)をし肉眼的な所見にたよっていたが、この初歩的方法でいくつかの基礎的特徴を証明することができた。しかし、可成り明白にされたのは顕微解剖学の発達を待たねばならなかった。驚くべきことだが、1840年に至るまで動物やヒトの身体の顕微鏡的研究はなされていなかった。この当時のドイツの解剖学者(Schwan)は、植物と同じく動物体も細胞より構成されていることを証明した。前世紀を通じて、われわれが知っているように、細胞学説はめざましい発展をとげた。動物の細胞が固定、すなわち細胞の蛋白の凝固による死されたのち染色されうること。や細胞の種々の部分が種々の程度に染料を吸収するという発見(1850年頃)は、もう一つの画期的な出来事であった。最初に使用された染料はまず第一にカルミンであったが、今日の標準に照らせば満足のいく像を示したとは云えないものであった。ヘマトキシリンが導入(1890年頃)されてはじめて、真に細胞の微細構造を分析をやってのけることが可能となった。ついで他の方法がたくさん現れた。Weigertは髄鞘の選択的染色法やグリア組織の染色も考案した。硝酸銀で神経細胞を鍍銀するGolgi法は、神経系の微細構造を研究する新しい可能性を切り開いた。1890年頃導入されたNissl法も決定的に重要なものである。これは、アルコールで固定された切片標本を塩基性のアニリン染料(色素)で染色するもので、今もって神経系の細胞学を研究するのにあたって日常の方法である。同じ頃に、変性した髄鞘を示すMarchi法が開発され、それにつづいて多数の他の方法が発展した。特に重要なのは鍍銀法の開発で、この方法で変性した無髄の軸索や終末繊維を追跡することができるようになった。
数多くの組織化学的方法が考案され、神経細胞中の種々の化学成分が決定されるようになり或る種の酵素、たとえばコリンエステラーゼの出現(存在)を証明することができる。形態学の研究の分野で放射性同位元素を使用することにより、神経系のいろいろの核の発生(達)を詳しく研究する可能性を創り出した。加えて、神経細胞やグリア細胞の代謝過程についての知識を与えた。しかしながら、形態学者にとって最も重要な新しい研究の道具は電子顕微鏡であった。この30年間使用されてきたが、神経細胞、繊維、グリア細胞の非常に微細な詳細な構造に関する豊富な新しいデータが現れ、このため神経系のわれわれの理解は非常に増大した。最近、巨大分子の順行性、逆行性軸索輸送を繊維結合研究に利用する方法が発達(開発)された。これらの方法のいくつかを以下に簡単に述べる。

| 正常標本での研究 |
神経系の繊維結合にみられる多くの特徴は、一部髄鞘染色により、一部細胞体と突起を銀や金の塩基化合物でメッキ(鍍布)することによって、繊維を追跡することができる正常標本を顕微鏡的に調べることにより明らかにされてきた。後者の方法は、特に下等な構造の簡単な動物で有益な情報を与えてきたが、これらの多くの場合、どこに繊維が終わるかを正確に記述することは不可能であった。これらの方法の一つであるGolgi法は近年再び評価され復活した。これは主として神経系の近代の電気生理学における進歩の結果である。その分野では、しばしば、得られらた所見を評価する際に軸索の側枝や樹状突起の分布(状態)を知ることが重要となるからである。中枢神経系の定性的および定量的電顕的研究は、光(学)顕的Golgi研究と併用した時、有益で実のあることを証明したGolgi法の今日的使用を啓発するいくつかの論文は”Golgi生誕100年祭シンポジウム:神経生物学の展望、1975”のなかに見られる。) Golgi法によって無作為の細胞のみ鍍銀される。この方法は数10年の間、1ヶの細胞の拡がりとすべての突起のタイプを可視化する唯一の手段であった。Fig.1-1は前庭神経核からとった1例を示している。しかしながら、近年、マイクロピペットを用いて1ヶの細胞にイオン化泳動的に(微小イオン化泳動注入装置を用いる)注入する技術をもってして1ヶの細胞とその軸索を樹状突起を可視化することができるようになった。
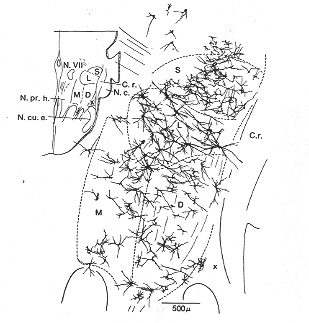
FIG.1-1 Drawing of a Golgi preparation from the lateral vestibular nucleus in the cat illustrating the various sizes of cells and orientation of dendrites in the four main vestibular nuclei as seen in a horizontal section (cf. inset avove). S, L, M. and D: superior, latedral, medial, and descending vestibular nuclei. From Hauglie-Hanssen (1968)
種々の物質が、Procion黄、コバルトイオン、三重水素標識のアミノ酸などが標識物質(マーカー)として使用されてきている。図1-2は3H-leucineを神経細胞にこの方法で注入した例を示す。アミノ酸はとりこまれて蛋白(プロテイン)に合成され、神経内を輸送されオートラジオグラフ法で可視化される。double-barreledピペットを用いることによりそれらの1つは細胞内の電気的ポテンシャル(電位)の変化を記録することに用いることができるので、この方法は生理学的に同定された(behavior性向が明らかとなった)特定の細胞を正確に同定し得るようになった。神経内輸送と単一細胞標識の問題についての広範なreviewに関しては、KreutzbergとSchubert (1975)やSchubertとHollander(1975)をみよ。単一細胞の樹状突起と軸索(及びその側枝)は細胞体(perikaryon)中にHRP(後出)に注入することによっても研究することができる。(例えばJankowska, RastadとWestman, 1976; Snow, RoseとBrown, 1976; Mc Crea, BishopとKitai, 1976をみよ)。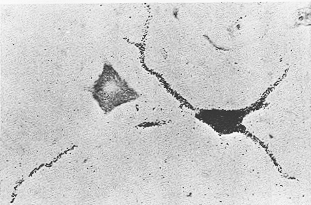
FIG. 1-2 The soma of a motoneuron in the spinal cord of the cat has been injected iontophoretically with 3H-leucine. Thirty minutes after the injection, labeled proteins are visualized autoradiographically in the dendrites. ×320. From Schubert (1974).
いわゆるmyelogenetic method(髄鞘形成法)、Flechsigにより導入されたものだが、異なる繊維系は胎生および生後初期において、髄鞘化する時期が異なるという事実を利用するものである。この方法は今日では殆ど使用されていない。

ヒトにおける病的状態の研究および動物での実験的研究
繊維結合に関するわれわれの今日の知識の実に大部分は、神経系に傷害をうけたのちにおこる“変性degeneration”の病的状態の研究によって達成されている。種々の部分に病巣をもったヒトの病理の症例も研究に利用されるが、動物に実験的に傷害を与えるという研究の方がより成果がみられる。実験的研究では、通常テストコンディションを自由に変えうるという利点があるが、ヒトの場合では、勿論、それは不可能である。加うるに、ヒトの病理の場合には、病巣はしばしば大きく広がっており、いくつかの異なる領域にわたっておるのできちっとした結論を引き出すことができない。他方、研究に適したたくさんの小さな病巣が明らかに人の脳にあるが、それが大変小さいため症状を呈さず、従って研究されていない。実験的に加えた傷害とヒトの症例に見られる病巣との間には本質的な相違はないのである。傷害(病巣)にともなう二次的変化も又同様でその研究に用いる方法も同じである。勿論、動物実験で得られた結果を人間に適用するにあたり注意を払わなければならない。脳では死後変性(化)が急速におこるので、ヒトの材料に殆どの形態学的方法を用いるときの大きな問題点は、適切に固定された材料を入手するすることがむづかしいことである。脳の生検を施行することでこの困難性を避けることもできようが、これは明らかに制約のあるところである。

Gudden(グッデン)法、新生動物における二次的萎縮
1870年頃ドイツの解剖学者B. Guddenは次のことを見い出した。すなわち、例えば生後まもない兎の大脳皮質に傷を与えて7-8週或いはそれより少し長い期間、経てから脳を調べてみると、その皮質傷害部位からおこる繊維系は完全に消失し、再吸収され、侵された(変性を受けた)繊維が送られる神経核は減少し萎縮していた。最初グッデンは彼が新生動物に傷を与えたのちに見たこの萎縮は、傷害又は破壊された部分からおこる繊維系をのみを侵害する(悪影響を及ぼす)という意見であった。後日そうではないことがわかった(von Monakow, 1880年頃)。傷害又は破壊されたのちにそこに終止する繊維の経路もまた変性をうけた。大脳皮質傷害ののちにそこに終始する繊維やそれらの起死核、たとえば或る種の(いくつかの)視床核の萎縮や衰弱(Waste)も出現したのである。

成育した動物やヒトにおける二次萎縮
新生の動物でみられるこのような顕著はWastingが完成に成育した動物ではみられぬことは特徴的である。傷害を受けた系での若干の萎縮や量(体積)の減少は起こるが、いつまで遅くまでつづくわけでなくその程度も低い。であるから成育しきった動物でも二次萎縮が繊維結合の研究に利用することもできるが、この方法は多少とも粗雑なものとなる。このような場合は、通常、髄鞘染色標本が用いられる。ここでは健康な有髄の系は青味を帯びて染色され、侵された系においては(軸索のみならず髄鞘も崩壊disintegrateされるが)淡染(pala)する。内包に出血が起こったために半身麻痺hemiplegiasのおこった古いcaseで、脊髄の横断髄鞘切片でみると、青黒く染色された白質の内に2つの淡染された領域として侵害された錐体路をみることができる(Fig. 1-3)。繊維結合の大雑把の特徴は判るがこの方法は詳しい研究には不適である。
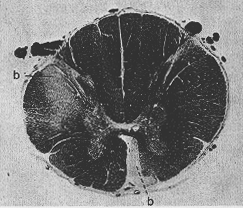
Fig. 1-3 Photograph of a myelin sheath stained preparation of the thoracic spinal cord from a patient who had a cerebral hemorrhage several years before he died. The light areas (b) in the lateral and ventral cortifcospinal tracts are due to the disappearance of the myelin sheath around the degenerated nerve fibers of the tracts.
今述べた相違は、動物のみならず人でも然り。
幼若時の侵害は成人時の侵害に比して軽いとよくいわれるが、これには問題がある。
cp. Isaacson(1975a)
これまでのべた研究方法のほとんど、大量の侵された細胞や繊維の検索にもとずいている。このことは、可成り広い範囲の侵害を必要とし、多数のニューロンが侵されねばならぬことを意味している。この事実の故に、詳細なる研究はこれらの方法を以てしては出来ぬ。

| 古典的なニューロン説 |
ここでニューロン説について若干述べることにする。この説は1890年頃導入されて、HisやRamon y Cajalによって強い支持を受けた。そしてForel, Koelliker, von Monakow, Waldeyer.他の前世紀後半の著名な解剖学者や神経学者に承認された。ニューロン説の最も重要な主張は、神経組織は、他の組織と同様、genetic, anatomical, functional , and trophicのunit(単位)であるところの個々の細胞から構築されているということである。神経細胞とその突起から成るニューロンなるものは、神経組織の構造上の単位であり、しかもニューロンは、神経刺激を伝導する神経系における唯一の要素である。樹状突起と細胞体はreceptive受容するものである。−すなわち、これらは、他のニューロンからの刺激により活動される− 一方、軸索は、ニューロン内に起こるインパルスをその終末部に送る(ニューロンの“動的分極”)。他のタイプの細胞、種々のグリア細胞、ependyma(上衣細胞−脳室と脊髄中心管の表面を覆う単層立方と円柱上皮)脈絡叢中の上衣細胞epithelium、結合組織細胞らは他の機能的役割をもっている。この古典的ニューロン説は神経系に対するわれわれの解釈におけるcentral pointであって、作業仮説として大変有益であることを証明してきた。
数10年間ニューロン説の支持者は他の研究者(しばしば“網状説”支持者reticularistsと呼ばれている)により異を唱えられてきたが、彼らは大部分鍍銀標本を基にして、神経細胞間は細い繊維より連なっている(continuity)と主張してきた。これについてはニューロン説支持者によれば細胞への終末は単なる接触(contact)である。ニューロン説の長短についてCajalにより慎重に評価evaluateされたがそれは彼の死後20年英訳で出版された単行本に見られる(カハール、1954)。この論争が決定的に神経元(ニューロン)説の勝利として決着ついたのは電顕的研究によってであった。神経終末は他の神経細胞やその樹状突起に軸索の最終枝や側枝が接触しており種々と形態学的に異なっているが、常に2つのニューロンに属する要素elementsの間とは明らかに分離separationがある。図1-4は電顕的に観察された軸索の終末膨大(終末ボタン、終末束)と神経細胞との間に見られる最も普通にみられる接触の例を示している。終末ボタンと神経細胞との間には約200Å(Å=Angstrom単位:1ミクロンのの1万分の1、10-10m, 10-8cm)の細隙がある。(光の波長[の単位]は現在普通nanometers, nmが用いられている。1 nm=10 Å。このテキストでは古い単位を用いる)。接触部位に沿った或る部分で特別な部位がみられる(図1-4の矢印間)。この部位はブトンから細胞へ刺激の伝達が起こると信じ(考え)られている領域でシナプス部位を表す。神経の機能を理解する上で重要なことなのでシナプスは以下別に考察しよう。特に強調すべきことは、ニューロンは単に構造上の単位であるばかりでなく。たいていの場合、ニューロン説でそのような定められたように栄養部位trophic unitでもある。このことはニューロンを含む傷害において一目瞭然で、以下にみるように、この基本的事実が神経系とおける繊維結合の研究を正確になしうるのである。
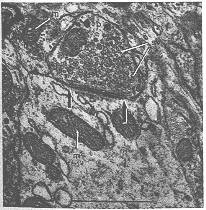
FIG. 1-4 Electron micrograph showing synaptic cantact of terminal bouton (b1) with a thin dendrite (d). Note membrane thickenings (between arrows) and subsynaptic condensation of material in the dendrite. To the left three other boutons (b2, b3, and b4)in contact with the dendrite, but the synaptic complexes are not included in the section. m: mitochondria; sv: synaptic vesicles. Scale line 1μm.

シナプス
シナプスという言葉は1897年Sherringtonによって、神経刺激の伝達が起こる2つのニューロン間の接触部位に対して作られた。すなわち、これは機能的な術語ではあったが刺激伝達の現象に対する構造上の基礎があるという意味を含んでいる。光顕標本で、いろいろな神経繊維終末の型が観察されている。シナプス前構造のありふれたタイプは上述したシナプス・ブトンで、軸索の枝や側枝の終末でみる小さな球状体(Sheruler of bulb)として現れる(Fig. 1-7図をみよ)。このようなブトン像は、細胞体表面にも、樹状突起にも、軸索にも見い出される。従ってaxosomatic, axodendrite, axoaxonicシナプスといわれる。ブトンの大きさは色々あるが、普通、直径が0.5〜3 μmのものである。特殊な染色法によって、少なくともある部位で、細胞体と樹状突起の全表面がブトンにより密に被われているのをみることができる(Fig. 1-5)。電顕は、神経細胞間に起こる数々のcontactの微細な研究を可能ならしめたし、古典的方法で作成した標本でみられた2つの神経細胞間の接触が必ずしもシナプスを作ってないことをもはっきりと示した。
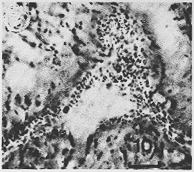
Fig. 1-5 Photomicrograph of a ventral horn cell of the cat lumbar spinal cord, stained with a special chrome silver method for demonstaration of terminal boutons. Parts of the surfaces of dendrites and soma of a cell are in focus and are seen to be studded with terminal boutons of somewhat varying sizes. From Illis (1973a).
シナプス結合のprototypeは図1-4に示されている。シナプス前終末presynaptic terminal、ブトンにはミトコンドリアがぎっしりつまっている(恐らく酸化的リン酸化oxidative phosphorylationの高率なることを示している)。シナプス後構造物(細胞体や樹状突起)との接触部位では特に、ブトンは多数の直径300-600Åのシナプス小胞と呼ばれる小さな胞vesicleを含んでいる。ある種のブトンの中には”dense core”芯をもった特殊な小胞がみられ、これらは一般に生体アミンに関係していると考えられている。時には”complex vesicles”やfine filamentsもみられる。シナプス前膜とシナプス後膜の接触の部位に電子密度の高い物質のcondensationという形の特殊像がみられる。これら2つの領域の間にある通常150Å-250Å幅のシナプス間隙の内にもしばしばcondensationがある。シナプス、たとえば大脳皮質などで、この物質はシナプス間隙を橋渡ししている一連の細かいフィラメントとして現れる。種々のorganella小器官もシナプス後膜肥厚の下に記述された(Gray and Guillery, 1966; De Robertis 1967: D.G. Jones, 1975, 1978のレビューをみよ)。
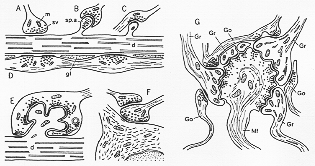
Fig. 1-6 Diagram of different types of synaptic contact as seen in electron micrographs (cf. text). Abbreviatioins: d: dendrite; gl: glial cell; m: mitochondrion; sp. a: spine apparatus; sv: synaptic vesicles. To the right (G) an example of a complex synapse, showing some of the elements in a cerebellar glomerulus. A mossy fiber ending (Mf) establishes synaptic contact with dendritic branches of several granule cells (Gr). Collaterals of Golgi cells (Go) end obn the latter dendrites. Diagram G adapted from Szentagothai (1965a).
上述したシナプスの原型には数多くのvariationがある。そのいくつかを図1-6に示してる。ブトンが細胞体又は樹状突起につくことがある(1-6A図)。樹状突起の上で、ブトンが神経細胞の樹状突起の上にしばしばみられるspines(棘、トゲ)に、しばしばシナプス結合をしている(1-6B図)。これらの棘はGolgi標本で初期の研究者により認められていたが、多くの人たちにより、以前は人工産物と見なされていいた。ブトンが棘全体を取り囲むこともある。ある種の細胞は、たとえば、海馬にある錐体細胞は樹状突起が非常に大きなイボ状のふくらみが生じそれが数個の棘状のtipに分かれているのがみられるが、その全体が1つの大きなブトンにつつまれて(1-6B図)そこは、ブトンと棘の間に多数のシナプス複合体がみられる。樹状突起の終枝がブトンの内に飛び出ることもある。樹状突起に沿って走るあるいは接近して位置する軸索が、いくつかの部分でいわゆるbouton en passage(通過性のブトン)(1-6D図)通過繊維がspineにcontactすることもある(1-6C図)。シナプスのこれらすべてのタイプでシナプス小胞はシナプス前要素にみられる。
(Garey 1959)
Type 1シナプス 厚い postsynaptic 肥厚
Type 2シナプス 薄い
Colonnier
Synmetricalシナプス preとpost同じ厚さ 平べったい(flatlened)
asymmetrical post厚い 丸い小胞(round)
(移行型もある)
シナプス小胞と膜の特殊構造部分が化学的にmediatedのインパルス伝達の真の部位であると現在、一般的に認められている。
伝達物質transmitter substance:シナプス小胞にboundしていると考えらている。インパルスがブトンに到達すると、伝達物質は恐らくシナプス前膜を通り抜けてシナプス間隙に入り、シナプス後膜での受容物質に結合する。

| transmitterについて depolarization, hyperpolarization |
1つのニューロンから2種(又はそれ以上)のtransmitter (see Burnstock 1976)同じ伝達物質でもそれをうける細胞のreceptorの性質で異なることもある。
electrical transmission - gap junction

| 繊維結合の実験的研究の基礎 |
前節で述べた様にニューロンは”trophic unit”としてふるまう。ごく最近にいたるまで、繊維結合の研究に利用されたすべての方法はこの事実に基づいている。軸索が切断されたとき、その末梢部は、終末分枝とブトンを含み、それに髄鞘も変性を起こす。この変化の一般的名称として、順行性変性という術語がしばしば使用されるが、順行性とは軸索内での刺激電導の方向を指している。しかしながら、切断部位より近位部のニューロンの部分も同様に侵される。これらの変化は逆行性と呼ばれ軸索の近位部細胞体および樹状突起がやられる。図1-7はこの過程の主な特徴を示している。更に図は、侵された軸索によって求心性入力を受けるニューロンをも侵すことがある。これらの変化はニューロン超えtransneuronalと云われている。これらの変化のうちどれを研究対象とするかにより、それを証明するための組織学的方法が異なる。
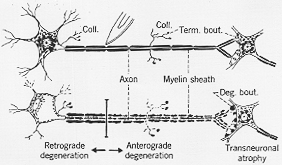
FIG. 1-7 Diagrammatifc representation of the changes in the neuron which follw transection of its axon. Above, the normal situation; below, the changes as they appear some days after the lesion, central to the cut (retrograde degeneration) and peripheral to it (anterograde degeneration). Below, to the right, the transneuronal changes are indicated. (See text for description.)

順行性変性anterograde degeneration
細胞体から分離された神経繊維部分の変化はしばしば一括してワオーラー変性Wallerian degenerationと呼ばれる。この変性は切断された繊維の髄鞘にも起こる。変性をうけた髄鞘はたとえばいわゆるマルキーMarchi法によって証明される。この方法はイタリア人Marchiによって1890年頃導入された。この方法は、変性した髄鞘が媒染剤たとえば重クロム酸カリで前処理されるとオスミウム酸液でimpregnateされるという事実に基づいている。この変化は受傷後、通常10〜20日後に最大となる。変性ミエリンは黒い点又は少し長い円筒状の粒子として観察される(図1-8)。正常の有髄繊維は淡黄色に染まりバックがすっきりしている。徐々に脂質小滴が脂肪酸に変化し、遂には完全に再吸収される。
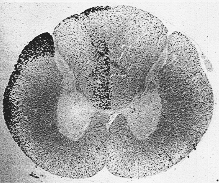
FIG. 1-8 A Marchi section from the 2nd cervical segment of a cat in which 15 days previously the lateral funiculus had been transected in the lumbar cord. Degenerating ascending fibers, interrupted by the lesion, are seen as black particles in the lateral funiculus. The degeneration in the ipsilateral dorsal funiculus in due to damage inflicted on dorsal roots at the level of operation.
動物の実験で1年後でも変性産物はみられるけれども、マルキ法は受傷後一定期間の範囲内でよい結果が得られる。(上述)(Glees, 1943)。Marion Smith (1951)は、繊維路のdivision後13ヶ月に至る期間変性繊維を追跡(trace)することがヒトの材料で利用できることを示した。マルキ法を用いる場合、繊維系と動物種で適正時間が異なることに留意すべきである。すべての研究方法はいくつかの誤源により妨げられる。そしてマルキ法も例外ではない(マルキ法でみられる人工産物の詳しい研究はM. Smith 1956bをみよ)。批判的に使用することによりマルキ法は、神経系の多くの結合に価値ある情報を与えてきた。
上述の如く、大抵の軸索終末枝は、terminal boutonsと呼ばれる小球状の膨らみをもって終わる。鍍銀法で、終末ブトンが用いる方法によるが、大小さまざまのリング状を呈したり内まで染まった球状を呈してみることがある。切断された軸索の遠位部が崩壊したときその終末ブトンも変性におちいる。それらは普通、ふくれ上がり、不規則状になり、嗜銀性argyrophiliaが増大する(図1-7をみよ)。これらの過程は2-3日中おこる。

variation
系による違い
陰性所見はmisleading誤りをおかしやすい。なぜなら、生存期間の不適当もある。
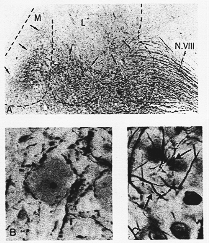
FIG. 1-9 Photomicrographs from sections treated with the silver impregnation methods of Nauta (1957) and Glees (1946). A: From a transverse nauta-impregnated section through the lateral (L) and medial (KM) vestibular nuclei in a cat, 10 days after transection of the vestibular nerve (N. VIII). ×20. The terminal areas (arrows) are clearly indicated by the presence of darkly stained degenerating fibers. From Walberg, Bowsher, and Brodal (1958). B: From a Nauta-impregnated section of the spinal cord of a cat 6 dayts after a lesion of the contralateral primary sensorimotor cortex. Degenerating fibers and small fragments, some of which are presumably terminal boutons, are found close to the cell bodies. ×330. From Nyberg-Hansen and Brodal (1963). C: From a Gless-impregnated section of the spinal trigeminal nucleus in the cat 5 days after a lesion of the frontolparietal cerebr4al cortex. Extremely fine degenerating fibers, some of them indicated by arrows. ×530. From Brodal, Szabo, and Torvik (1956).
変性ブトンや繊維の研究にいくつかの方法がある。それらのいくつかの方法(e.g. Glees法 1946)を用いると、正常繊維も変性繊維(ブトン)も鍍銀される。これは変性粒子を区別することがむずかしいし労が多い、とくに変性の量が少ないときには。しかしながら、非常に細かい変性繊維が同定される(図1-9Cをみよ)。NautaとGygax (1954)によりあみ出されたそしてNauta (1957)により改良されたmodified silver impregnation method は大いに用いられた。うまくでき上がった標本では変性した軸索と枝のみがimpregnateされる。黒い変性物と黄味の正常構造でバックがきもちよい。終止部位である核、又は核のうちのその一部まで大変綺麗に低倍率顕微鏡でしばしば区別される(1-9A図)。
通過繊維をみるにも良い。
細胞体を囲むように又は、近位に樹状突起に沿って…
色々の鍍銀法は、変性繊維や終末枝のimpregnationに関して異なっているものであるということを知っておくことは大事なことである(Heimer, 1967, for a survey,をみよ)。であるから陰性所見は決定的なものとは云えない。研究者が今のべたことがらを知らない。でおこったために、異なる所見に時折論争が起こって来たためである。
Walberg (1964) 終末もみる。 (以前、Nauta法は終末像まで現れぬと思われた。)
EM.
Nauta法の改良→FinkとHeimer法(1967 synaptic contact)の最終決定はEMによる。

EM変性
dark type, filamentous type

逆行性変化
当初誤って変化は起こらぬと思われていた(control part of the axon)
ミエリン鞘の変化は明白でない。

末梢のニューロンにおける逆行性細胞変化
軸索切断後に細胞体に変化が起こることを最初に正確に伝えたのはNissl(1892)である。顔面神経を全部取り去ってしまって(ラビットで)VII核の細胞をみた。
tigrolysis虎斑融触(ニッスル小体が散がり、チリ状の塩基性物質となる)。中心部から始まる。数日のうちに細胞質全体にひろがる。cytoplasmの中心部は”milky”状となる。仁が周辺に(偏在)axon hillockの反対側に、しばしばぺしゃんこになる。細胞はますます丸味を帯び、外観上多少ともふくれる。7-10日後に顕著になる。このとき正常細胞とははっきり区別される。
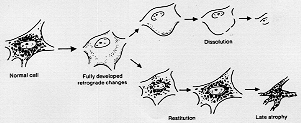
FIG. 1-13 A diagram of the usual course of the retrograde cell changes in peripheral motor neurons. To the left a normal cell. From the stage of the fully developed retrograde changes the cell may disintegrade (above) or recover, but the frequently the cell atrophies later on (cf. text).
Nisslはこのstageをprimare Reizungと名づけた。脊髄のmotoneuronでもみられる。
Nisslはprimare Reizung以後の変化については研究を進めなかった。1900年頃幾人かの研究者がNisslが記載した細胞変化を見なして再び研究して、primare Reizung後のVII核は多少異なったふるまいを演じるという面白い発見をした(図1-13)。つまりますますふくれたり崩壊が進むか、以下の仕方で回復されるかという。d.h.最初中心部に虎斑物質が再現する。細胞は小さくなり、再び正常の外観を呈し、核が中心に位置するようになる。しかし、かなりの時間が経過すると、これらの回復した細胞は徐々にに萎縮し、小さくなり暗色味を帯びてくる。後日判明したところでは、再生細胞が筋に接続することができぬとき起こるものである。
運動核や脊髄motoneuronだけでなくこれらの変化は、脊髄神経節や脳神経の神経節でもおこる。

中枢ニューロンにおける逆行性細胞変化
ニッスルがfacial nerve(VII)細胞で記載したprimare Reizungは同じ様な仕方で、すべての他のタイプのニューロンにも起こるものだと最初信じられたが、事実はそうではなかった。反対に、軸索の切断後に起こる初期変化は実に可成り様々であった。
軸索切断後、ある細胞はふくれずして小さくなる。核は偏在するとは限らない。最も重要なことは、ニッスル小体の融解 −chromatocysis or tigrolysis− もいつも起こることは限らない。起こっても中心部から始まらぬことがある。
逆行性反応の初期段階におけるこれらのvariationsは末梢ニューロン(たとえばCammermeyer, 1963をみよ)のみならず中枢性(すなわち、軸索をCNS外に出さぬニューロン)と呼ばれるニューロンにも見られる。末梢ニューロンと中枢ニューロンとの間の重要な相違は遅れた時期(切断後の)に現れてくる。中枢での結合では侵されたニューロンのあるものは急性に崩壊するが、回復restoredするものはない。崩壊しないものは徐々に萎縮が進み数ヶ月を経て顕著になるものがある。細胞の変化とタイムコースに関しては神経核によっても動物種によっても違いがある。であるからすべてのニューロン系でprimare Reizungの典型像を見い出すことを期待することはできない。
初期の逆行性の変化の像が多々あることと結果が不確実であるために、他のprocedureが大いに用いれた。すなわち、しばしば逆行性萎縮retrograde atrophyと云われている晩期逆行性変化の検索である。動物は受傷後数週とか数ヶ月の生存期間をとる。
数→減り、大多数の切られたaxonのcell→萎縮
この方法は時に所見があいまい。
Brodal (1939)幼若の兎:猫を用う(8-15日令・手術日)
このふるまいof cells changeは成育したものとちがってハッキリしている。d.h. 4-5日経つと幼若令では特徴的な逆行性変化が起こる(adultはあいまい)。更に数日経るとすべての細胞が完全に崩壊する。
a modified Gudden Method (Brodal 1939, 1940a)

ニューロン超え(シナプス超え)の変化
軸索輸送を利用した方法
生理学的方法で線維結合を追跡する方法
誘発電位を記録する方法
revisionを要するニューロンドクトリン!!
(古典的ニューロン説の改造)
Golgi I. II cell
dendrodendritic
dendrosomatic
somatosomalic
electrotoric synapse
spike伝達→1つのニューロンにおけるgraded changesが丘のニューロンにおける電気活動をシナプッスを通じてsynaptically o〜を与える。
“local circuites”
再生・可塑性

最終更新日:2002/09/13