| 第11章 自律神経系、視床下部 The Autonomic Nervous System The Hypothalamus |
要約:筑波大学基礎医学系神経内分泌学:野上晴雄
自律神経系(あるいは植物性、内臓性神経系)は、最近重要度を増している領域で、従って十分な記載を必要とする。以下、重要な解剖学的要素と基本的な生理学的知見を記し、最後に自律系の障害例から得られた臨床的知見についても述べることにする。
本来自律神経系あるいは植物性神経系は交感神経幹や内臓の神経叢のように中枢神経系の外で構成される神経系であると考えられていた。しかし、脊髄や脳幹の神経細胞が自律神経系に線維を起こることが解り、また、間脳に自律系の統合中枢が想定されるに及び、この考え方は不適当となった。大脳皮質が自律神経系固有と目されていた機能に影響を与えることが明らかにされたことにより、中枢神経系とその外に位置する自律系という考え方は意味を為さなくなった。例えばGreving(1928)のようにもっと一般的に自律神経系を規定することは可能であるかも知れない。即ち、自律系とは内臓の筋(平滑筋)や腺に分布するすべての神経細胞及びそれに由来する線維のことである。これらの要素は、通常無意識のうちに行われる制御機構として機能している。形態学的に見ると自律神経系には重要な構造的特徴がある。つまり、中枢から内臓へ至る遠心性自律系は常に2つのニューロンからなる。中枢に細胞体を持った節前ニューロンと中枢の外に細胞体を持った節後ニューロンである。中枢神経系に存在する自律神経系の細胞は形態学的にも体性神経系の神経細胞とは異なるし、しばしば自律系の細胞は独自の細胞群あるいは神経核を構成する。自律神経系はは交感神経系と副交感神経系とに分類される。生理学的研究結果に基づいてLangleyによって導入されたこの考え方は主に自律系の遠心性要素にのみ適用されるものである。求心性要素にこの考え方をあてはめるのはどうか。一般に内臓性求心線維あるいはインパルスという言い方をし、混乱を防いでいる。
ヒトでは交感神経系の節前ニューロンの細胞体はすべての胸髄とL1,2に存在する。これに対し副交感神経系の節前ニューロンの細胞体は脳幹のある特定の部位と第3、第4仙髄に存在する。即ち胸腰システムと脳仙髄システムである。交感神経系と副交感神経のもう一つの重要な形態学的相違は、節後ニューロンの細胞体の位置である。交感神経系では、節後ニューロンは脊柱付近、即ち交感神経幹に存在するのに対し副交感神経系では標的器官内あるいは器官の壁内及びその近傍に位置する。このような解剖学的位置特性から見ても交感神経系は生体全体に影響する"拡散性の反応"を与えるのに対し、副交感神経系の構築はその作用がより局所的な効果をもたらすと考えられる。まあだいたいこれでOKだ。多くの場合、交感・副交感神経系は互いに相反する作用を示す。即ち、一方が抑制的・阻害的であり、他方は刺激的・促進的に働く。薬物はこのうち一方に特異的に働く。例えば、副交感神経系に対してアトロピンは麻痺をさせるように、ピロカルピンは刺激的に働くというように。さらにこの2つの系は伝達物質(ホルモン)にも特異性がある。交感神経系のホルモンはノルアドレナリン、副交感はアセチルコリンである。
このような形態的、生理学的相違は両システムが明確に区別できるものと考えさせるが知識が集積されるにつれてこのような固定的な考え方は注意を要するということが解ってきた。
交感神経系と副交感神経系の拮抗作用は当初考えられたよりもずっと流動的である。(たとえば眼や膀胱では交感神経の作用は全くminorで副交感神経のtoneの変化だけで十分機能が説明できる)上記のような交感・副交感の定型におさまらない形態学的、生理学的事象もあるし、両系の区別といったものは自律系の高等な中枢になると事実上不可能になるのである。植物性機能に関する拮抗作用を除いては自律神経系の2つのシステムは、多くの場合協力的に働くのだということを理解することが重要である。両システムは様々な内臓器官が適正な働きを保つために協調して作用する。自律系の作用は交感・副交感の相互作用ばかりでなく体性運動性のシステムとも協調する。即ち、血管運動性の変化は横紋筋の機能にも影響を与えるのである。さらに内臓性と体性機能を担う構造の形態学的区分は、中枢神経系のより高等なレベルになるに従って難しくなる。より高等なレベルでは内臓性機能の統合センターは体性機能の統合センターと機能的に区別できないことがある。修正が必要であるという前提にたてば、自律神経系を単純に交感神経系と副交感神経に区別することはOK。次の項目ではこの考え方が有用である。
交感神経系節前ニューロンの細胞体はすでに述べたように胸髄と腰髄の上部2節に存在するが、ヒトとイヌでは下部頸髄にも存在する。このような細胞は脊髄の灰白質中に特異な細胞集団として存在し、中間外側核を構成する(下位脊髄の中心管の近傍に中間内側核を記載するものもいる。Laruelle 1937はこれを検討し副交感神経系に含まれる細胞群であるとした)。細胞体は運動ニューロンに比べて小さく形態も多様である。核は比較的大きく核小体が明瞭である。細胞質は細胞内小器官が少なくこの点でも運動ニューロンと異なる。ゴルジ法で見ると樹状突起はおおむね脊髄の縦方向に配列しており、側索から微細な軸索が進入している。電顕的に見るとこの軸索は樹状突起をclimbし、3種類のterminalでシナプスを作っている。このうち多くは有芯小胞をもつものでおそらくnoradrenargicである。中間外側核のニューロン自身は前根を通って脊髄を出、脊髄神経の前枝、白交通枝を通って交感神経幹に入る。
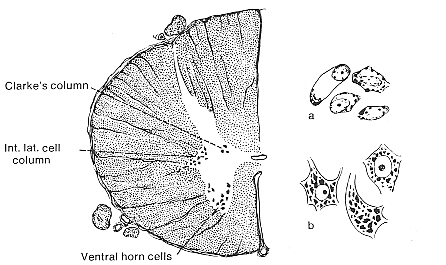
FIG.11-1 Drawing of a Nissl-stained preparation from the thoracic spinal cord of man. To the right, representative cells from the same section drawn with higher magnification. Note the differences between the somatic motoneurons from the ventral horn (b) and the visceral efferent cells from the intermediolateral cell column.
副交感神経系の節前線維の起始細胞は、脳幹の幾つかの神経核と脊髄に存在する。脊髄の副交感線維は、(S2)S3,S4の上位脊髄では中間外側核に相当する部位の神経細胞から出る。副交感神経の節前線維のうち脳から出るものは、いくつかの脳神経に分流し一般内臓性遠心性線維を構成する。このような線維の起始細胞はおおむね体性遠心性核の付近に存在する。副交感性の自律線維は、III、VII、IX、X脳神経に含まれているが、大半は迷走神経(X)に含まれる。これは第4脳室に面した舌下神経核の外側にある迷走神経背側運動核からでる。迷走神経を頚部で切断すると退行性の変性を引き起こす。これは背側核以外に他の遠心性細胞を含む疑核の変性を伴う。7章で述べたように、疑核の細胞は運動ニューロンと同じであり、迷走神経背側核の細胞は中間外側核(脊髄の)の細胞と同様である。即ち、疑核の線維は咽頭が喉頭及び食道の横紋筋に至るのに対し、背側運動核の線維は腺、平滑筋、心臓へ至るのである。横隔膜の下で迷走神経を切断すると、ここから先横紋筋への迷走神経supplyはないので退行性変性は背側核にしか及ばない。最近では疑核の線維は一部心臓へもいくことが解っている。
背側運動核の中でも部位により細胞形が異なることがヒトでも動物でも明らかになっている。迷走神経の様々な枝を切断しその結果起こる退行性変性を調べることにより、背側運動核内の部位差が標的器官の違いを反映しているのかどうかを知るという試みがなされている。
内臓遠心性(副交感性)線維のうち舌咽神経と顔面神経(中間神経)に含まれるものは、それぞれ上・下唾液核から起こりその主な作用は唾液腺の支配である。これらの核は小さな核で、迷走神経背側運動核の吻側への延長上にある。Torvik(1957)はネコで舌咽神経と迷走神経の内臓遠心性線維には網様体のある領域に散在性に存在する細胞に由来するものもあり、このような細胞は明確な神経核を作らないことを示した。このことは後にHiuraによりHRP法で確認された。
瞳孔括約筋と毛様体付近に分布する動眼神経に属する副交感線維は、他の一般内臓性遠心性線維と同様の型の細胞に由来し、その細胞体は外眼筋を支配する運動ニューロンとともに、上丘レベルの中脳水道腹側に位置している。いわゆるEdinger-Westphal核を構成するこれらの細胞は体性遠心性細胞の背側で正中線両側にある。これらの細胞から出た節前線維は動眼神経を通り毛様体神経節に至る。
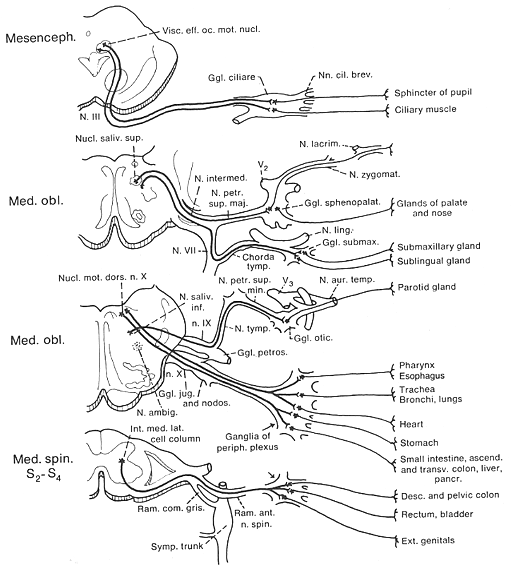
FIG11-2 Diagram of the craniosacral division of the autonomic nervous system. Preganglionic fibers indicated by heavy lines, postganglionic with light lines. The preganglionic fibers, their endings in the ganglia, and the distribution of the postganglionic fibers are indicated. Modified from Rasmussen (1932)
交感、副交感性線維の求心性細胞核はただその局在が異なるだけである。一つの例外を除いて内臓求心性線維のインパルスを中継する細胞集団は今のところ特定されていない。その例外とは弧束核でありこれは、顔面(中間)神経、舌咽神経、迷走神経の中の、求心性線維の終止核である。すでに述べたように一部の三叉神経の求心線維もここに終止する。弧束核はこれらの神経によってもたらされる口腔、咽頭、肺、食道、上部消化管、及び腹腔の腺などからの内臓性求心性線維の情報を中継する。これらの求心性インパルスは主に内臓反射において重要であるが、迷走神経成分はより広汎な、例えば吐気のような感覚にも関与する。交感神経の求心性線維と異なり迷走神経の求心神経は痛みの伝導には関与しない。交感神経の求心線維は脊髄灰白質の後角あるいは中間外側核の細胞に終わる。このような内臓性求心性インパルスに関する知識は乏しく、求心性線維に交感と副交感の区別を当てはめるべきかどうか疑わしい。求心性線維についての体性と内臓性を区別することは広く受け入れられているが、これも以前ほど確固たるものではなくなってきている。
自律神経系の末梢部分に関する知見は、臨床的な意味が大きい、交感神経系では、中間外側核からでた軸索は前根を通って脊髄をでるが、その後直ちにこれと別れ、いわゆる白交通枝を経由して交感神経幹に入る。交感神経幹は細胞の集団で出来た一対の鎖のような構造で、脊柱の腹外側に位置する。それぞれの細胞集団は縦方向に走る神経線維束により互いに連絡されている。横方向の連絡も存在し、ヒトでは第5腰椎以下で見られる。交感神経幹は白交通枝及び灰白交通枝により脊髄神経と連結されている。
もともと交感神経の神経節細胞の原基は脊髄の各分節の両脇に位置している。発達に伴いこの基本的なパターンは一部失われる。2-3の原基が融合することもあるし、一つの原基が分裂することもがあるかも知れない。その結果頚部では3つの神経節が残る。即ち、上、中、下頚神経節である。下頚神経節は第一、第二胸神経節と癒合しいわゆる星状神経節を作る。上頸神経節は長く大型で上部2頸椎の横突起の腹側に迷走神経のnodose ganglionに隣接して存在する。中頚神経節は第6頸椎 の位置に見られる。下神経節あるいは星状神経節は鎖骨下動脈の後方にあるのが普通である。中、下神経節の間には中間神経節が存在する。ここからの線維はansa subclaviaというループを構成して鎖骨下動脈の周辺を通って下神経節に連絡する。胸部では上の2神経節は星状神経節を構成するものの、他は通常各髄節に一つの神経節が存在する。腰部では4か5,仙骨部では通常4つの神経節が存在する。非対の尾神経節もよく見られる。交感神経の神経節の数、大きさ癒合の程度に個体差があるということは臨床的意味をもつ(脚注;SheehanとPickは、ヒトとサルの研究から神経節は位置によってナンバーリングするようりもその神経節がどの脊髄神経と交通しているかを重視すべきだと考えた)、交感神経節細胞は必ずしも交感神経節に局在するとは限らず、特に頚部と腰部では神経節細胞が灰白交通枝に沿って中間神経節として存在することもある。これは、交感神経節は後根及び前根に沿って移動する細胞によって構築されるからだという発生学的な説明が出来る。中間外側核の神経線維は有髄なのでこれらを脊髄神経から交感神経幹に導く交通枝は白く見える。即ち白交通枝である。脊髄の中間外側核の存在範囲に一致して、自律系線維束即ち白交通枝はTh1-L2にのみ見られる。節前線維、(これは白交通枝を通るが)のうちあるものはおなじ高さの神経節に終わる。しかし他の線維はここに終止せず通過する。これらは神経幹内を上行あるいは下行し、上位あるいは下位の神経節で節後ニューロンの細胞体にシナプスする。節前線維の一部は交感神経幹を通過し、標的内臓に関係したprevertebral gangliaへ行く。これらのうち最も重要なものは大および小内臓神経である(これらは節前ニューロンの軸索であり白交通枝に相当するものであることに注意)大内臓神経は5または6から9〜10胸神経節から、小内臓神経は(9)10と11胸神経節から起こる。これらはともに横隔膜を通過し、腹腔動脈周囲の腹腔神経叢に入る。ここで大内臓神経の節前線維は節後ニューロンにシナプスする。腹腔神経叢は腹大動脈の枝に沿って広がり他のいくつかの神経叢を構築する。このうち最も明確なものは上、下腸間膜神経節である。小内臓神経の線維は、主に腎神経節と副腎髄質に行く。さらに第12胸髄節の線維の一部はleast splanchnic nerveといわれ、副腎の神経支配に関与する。これらの神経節は胸腰神経の節前線維の終着点である。脊椎または脊椎前神経節内には節後ニューロンの細胞体があり、これは標的器官にむけて線維を伸ばす。節後線維は無髄線維で2通りの走行を示す。即ち節後線維は灰白交通枝として脊髄神経に戻るか、あるいは動脈神経叢としてこれに沿って走行するかである。
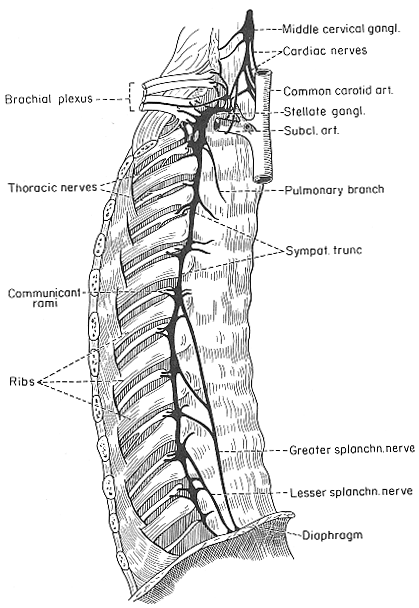
FIG.11-3 Drawing of the part of the right sympathetic trunk (back), showing some ganglia and their connection with the spinal nerves by communicant rami and the greater and lesser splanchnic nerves. Redwawn from Spalteholz.
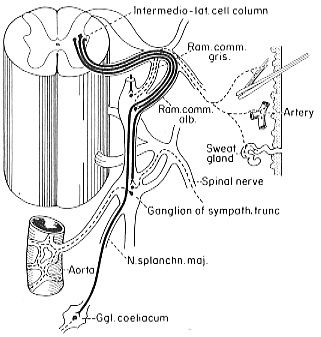
FIG.11-4 Diagram of the arrangement of the efferent fibers in the sympathetic nervous system. Preganglionic sympathetic fibers (solid lines) from cells in the intermediolateral cell column leave the spinal cord through ventral roots and enter the sympathetic trunk via white communicant rami to end in one or more sympathetic ganglia. Some preganglionic fibers continue in the splanchnic nerves. Most postganglionic fibers (broken lines) from cells in the ganglia reenter the spinal nerve via gray communicant rami and follow the nerve perpherally, for example to the skin, supplying glands and smooth piloarrector muscles or muscles in small vessels. Other postganglionic fibers pass to large vessels, for example the aorta.
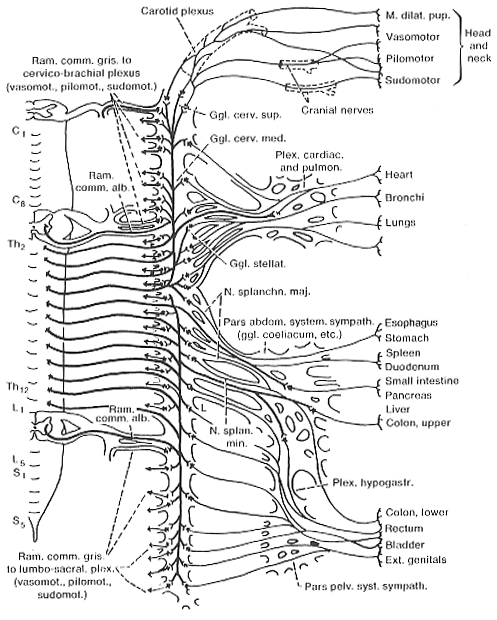
FIG. 11-5 Diagram of the sympathetic division of the autonomic nervous system. Same principal used as in Fig. 11-2. Moodified from Rasmussen(1932).
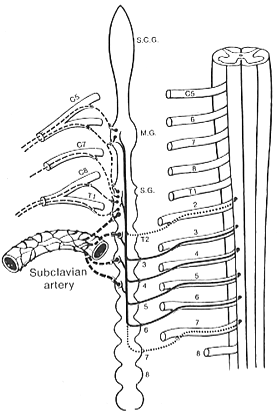
FIG. 11-6 Diagram of the origin and course of the sympathetic fibers to the upper extremity. The dotted preganglionic fibers are somewhat equivocal. Postganglionic fibers are indicated by broken lines. S.C.G.: superior cervical ganglion; S.G.: Middle cervical ganglion; M.G.: stellate ganglion. From Haymaker and Woodhall (1945) after Foerster.
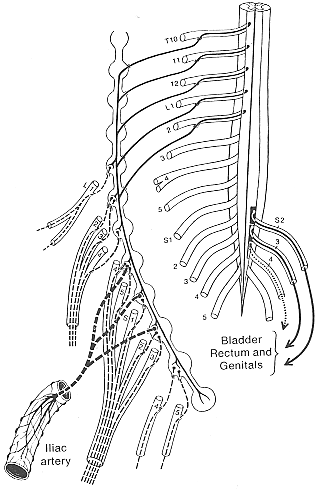
FIG. 11-7 Diagram of the sympathetic supply of the lower extremity following the same principle as in Fig. 11-6. The parasympathetic fibers to the pelvic organs are in cluded on the right side. From Haymaker and Woodhall (1945) after Foester.
灰白交通枝は白交通枝と異なり交感神経幹全長に亘って見られる。交感神経幹と脊髄神経を結んでいる。従って血管収縮、汗の分泌及びpiloarrection等を行う交感神経系の節後線維は脊髄神経に含まれている(白交通枝は有髄線維のみ、灰白交通枝は実際のところ両方を含むが肉眼的な区別は出来ない)。動脈に伴行する線維は神経叢を形成する。上頚神経節からでた節後線維のあるものは内頸動脈とその枝に沿って上行し頚部に送られる。このうちには、その後いくつかの脳神経に入るものも含まれる。星状神経節からの線維は鎖骨下動脈に沿って上枝へ至る。頚神経節からの他の線維は即ち上、中、下心臓神経でありそれぞれの頚神経節から起こり、上位4胸神経節からの交感節後線維及び迷走神経線維はともに心臓神経叢を作る。
腹部では腹腔神経叢からの線維は腹大動脈の枝に沿って走り、肝、脾、腎、phrenic他の神経叢を構築する。節後線維はまた、卵巣、精巣動脈に沿って起こる。また、腸間膜動脈とその枝に沿って走り腰及び仙骨部の神経節からの線維を加えて下腹神経叢(phypgastric)を作る。ここからほとんどの骨盤臓器に交感神経が供給される。小腸及び上行、横行結腸へは上腸間膜神経叢から、下行、S字結腸及び直腸へは下腸間膜神経叢から交感神経が供給される。下肢へは腰及び仙骨神経節から灰白交通枝を通って脊髄神経に入った交感神経繊維が至る。内臓の神経叢では、交感神経線維に加えて副交感神経線維も混在することを注意しなければならない。
中間外側核は脊髄のTh1-L2にしか存在しないのであるが、交感神経線維は全身に分布する。これは節前線維のarrangementによって可能となる。ある交感神経系の節前ニューロンは神経幹を上行あるいは下行する。このようにして、上位胸髄節から出た交感線維は上頚神経節に終わり仙骨神経節は下位胸髄節や上位腰髄節から節前線維を受けることが出来る。
副交感神経系の末梢部分について見ると、脳から由来する節前線維はいくらかの脳神経に入ることをすでに述べた。交感神経系に見られる改編と異なり、副交感神経の節前線維は標的器官まであるいはその近傍まで追うことが出来る。節前線維はそこで節後線維とシナプスし、標的器官の壁にはっきりしたあるいは、広く分散した神経叢を作る。動眼神経の内臓性遠心性線維は体性線維とともに走り眼窩に入った後体性線維と別れ、毛様体神経節に入る。ここから発した節後線維は短毛様体神経として眼球に入り毛様体筋と瞳孔括約筋に分布する。顔面神経に由来する節前線維は中間神経の一部として、上唾液核に起こり、複雑なコースをたどる。あるものは顔面神経管で別れtympanic cavityを通り(鼓索神経)脳を出た後は舌神経(lingual nerve)に入る。その後の舌下腺あるいは頚下腺に入る枝の中に節後ニューロンの細胞が存在する。顔面神経に含まれる他の副交感成分は、膝神経節で分かれ、great superficial petrosal nerve(大錐体神経)に入る。茎乳突孔(pterygoid canal)を通って蝶形骨を抜け、Spheno-palatine fossaのsphenopatatine ganglionに終わる。節後線維は、ここから発し一部上顎神経を経由して、涙腺神経と癒合、涙腺に至る。他の線維は鼻腔口腔に分布する。
舌咽神経中の内臓性遠心性線維は下唾液核からおこり、petrous ganglionで舌咽神経と別れる。Tympanic nerveを作って節前線維はtympanic cavity のfloorを貫通し内側壁を上行うすいcavityのroofを貫き頭蓋内にlesser superficial petrosal nerveとして現れる。これは再び頭蓋を出、卵円孔内側のoptic ganglionに終わる。ここから出た節後ニューロンはauriculotemporal nerveを経由して耳下腺に至る。さらに重要な副交感性の節前線維は、迷走神経に含まれている。これらの節前ニューロンは背側運動核から起きる(すでに述べたように、心臓へ行くものはおそらく疑核から出る)。
これらの内臓遠心性線維はいくつかのVagusのramiに分配され、標的器官内または近くの神経節に終わる。つまり因頭枝に含まれるものは咽頭神経叢の神経節に終わり、節後線維は咽頭の腺に分布する。食道にも同様の分布をする(腺分泌に関与する線維と筋への線維)。心臓は上、中、下心臓神経から副交感線維を受ける。この線維は心臓神経叢の特に大動脈、肺動脈起始部にある節後ニューロンにシナプスする。横隔膜を通過した後左の迷走神経は主に胃前面に右の迷走神経は胃の後面に分布、そして腹腔神経叢に線維を送る。ここからさらに十二指腸、膵、小腸、結腸に至る。肝神経叢に入るものは主に右の迷走神経の枝であり関門脈のあたりの神経叢でニューロンをかえる。胃壁中で胃神経叢が形成され、これは短い軸索をもつ節後細胞を含む。胃壁の神経叢のうち一つは筋層の間に形成され、もう一つは粘膜下層中に形成される。これらの神経叢には交感性線維も含まれる。これ以下の消化管にも同様の神経叢がみられるこのような神経節から発した節後線維は分泌性、運動性である。
仙骨部に属する副交感神経の節前線維はS3 or S4(時にS2,S5)から出る前根を通って脊髄を出る。これらはpudentall plexusを構成する神経をたどり、直腸の両側で骨盤神経としてこれを離れる。骨盤神経の切断実験からOliverら(1969)はS2とS3の中間外側核及び一部の中間内側核の細胞に退行性変性を観察した。HRPを用いた研究もこれと同様の結果であった。Satoら(1978)は、HRPを膀胱壁に注入しS2,S3の中間外側核細胞が標識されるのを確認した。末梢では副交感の節前線維はhypogastric pelxusに入り、交感神経と混在する。これらの線維は膀胱、直腸および生殖器官の壁の中で節後ニューロンとシナプスする。下行及びS字状結腸も仙骨部から副交感線維を受ける。副交感線維の起始がこのように限られているにもかかわらず交感の場合同様すべての内臓が副交感をうけている。末梢に行くと交感・副交感の線維は混ざり合うようになるが、それぞれの作用は保持されている。
自律神経節を構成する神経細胞は中枢神経系の細胞と幾つかの点で異なっている。いくつかの細胞型が区別できるし、神経節毎に形態が違ってもいるものの自律神経節細胞に共通する形態が見られる。交感神経系の節細胞と副交感神経系のそれを区別する十分な基準は見つかっていない。交感神経幹や末梢の神経節細胞は通常多極細胞であり、多くの長い樹状突起を有するのが特徴である。脊髄神経節の細胞のように自律系の神経節細胞は常に扁平な細胞によって表面を覆われている。多くの樹状突起はこれを貫通しているのかも知れない。この樹状突起が多いために軸索を同定するのは困難であることが多い。軸索は細く細胞体から、または樹状突起から起こることもある。節後ニューロンの軸索は通常無髄である。
神経節細胞間は多くの微細な線維でうめられている。これは主に樹状突起や節前線維の軸索あるいは副枝である。節後線維は無髄であるため光学顕微鏡で樹状突起と識別することは難しい。軸索の終止の様式は多様である。軸索は節後ニューロンの細胞体を覆うカプセル(sheath cells)を貫通するのかも知れないし、カプセルの外に出ている樹状突起にシナプするのかも知れない。軸索は通常bulbs chalyces, pericellular arborizationsで終わる。
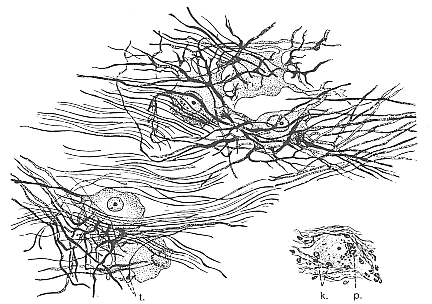
FIG. 11-8 Drawing of cell types from autonomic ganglia. Lower right, a cell from the celiac ganglion in man (autopsy material, modified Cajal method with contrast Safranin staining). The other cells are from a lumbar sympathetic ganglion of man (Bodian's method on autopsy material). t: terminal ramifications; k: sheath cells; p: argentaffine pigment (see text). Courtesy of J. Cammermeyer.
自律神経系の細胞を連絡する線維は例えば白交通枝のように通常有髄である。ただし、灰白交通枝や動脈周囲の神経叢は無髄である。一般的に言って節前線維は有髄、節後線維は無髄ということでいい。
自律神経系の節細胞の形態は複雑なので、記載に不一致が多く見られる。電顕的観察は、より詳細な情報をもたらしたが基本的には光学顕微鏡での記載を肯定している。
光顕観察に基づいた初期の研究では、神経細胞は合胞体であると考えられた。この考え方によれば自律系の末梢枝には、ニューロン説はあてはまらないことになる。しかし、電顕の開発のずっと以前からLangleyが生理学的実験から結論したように、多くの人が節前線維は交感神経節でシナプスを作ると考えていた。これは、その後電顕で確認されている。自律神経節細胞の構造は非常に詳しく研究されているが、ここではその一部を記述することにする。シナプスの形態は先に述べたように多様である。Axosomaticシナプスも見られるが、最も多いのはaxodendriticである。これは神経節によってあるいは動物種によって多少異なる。シナプスの形態は中枢神経系の場合と同じである。例えば毛様体神経節や上頚神経節に侵入する節前線維はコリンエステラーゼの証明法によって染色することが出来る。そして、この線維の中のあるいはシナプスにはアセチルコリンが存在するようである。ほとんどのシナプス終末には小型の無顆粒性シナプス小胞が含まれており、これはコリナージックな情報伝達をすると思われる。しかし、交感神経線維の終末には多数の大小の顆粒小胞(有芯小胞)が混在している。小型の有芯小胞はモノアミンと関連しているように思われる(このような終末は節前線維の終末ではなく、神経節内の細胞から出た軸索の終末であるという考えもある)。
組織化学的研究は、交感神経系と副交感神経系の神経節に明確な相違があことを示した。Flack-Hillarpの方法で調べると交感神経幹のほとんどの細胞はアドレナリン作働性である。しかし組織化学的研究によると一部の神経節細胞はコリン作働性である。このようなコリン作働性の交感神経線維は汗腺や骨格筋または舌に至り血管拡張作用を示す。毛様体神経節のような副交感神経系の神経節ではすべてのニューロンがコリン作動性であるが、すべての副交感神経節にこれがあてはまるかというと、それは良く知られていない。
このように、全体的に考えると最近のデータは以前から生理学的、薬理学的研究によって明らかにされていた"節前線維と副交感神経系の節後ニューロンはコリン作働性、交感神経系の節後ニューロンはアドレナリン作働性である"という考え方を支持している。しかしながら自律神経節は構造的機能的に不明な点がまだ多い、例えば神経節内でのシナプスの配列等は何も解っていない。
多くの交感神経節にはbichromate saltsで可視化されるいわゆるクロマフィン細胞が存在する。この細胞は小型で少数の細かい突起を有する。電顕的にこの細胞は、大型の有芯小胞をもっており従ってカテコラミンを多く含むと考えられる。機能的意味は不明確であるが、この細胞がいわゆる介在ニューロンとして機能するのかも知れない。
以上に述べた交感・副交感神経系の相違の他、さらに次のような差違も重要であろう。即ち節前線維と節後線維の数の比が異なるという点である。節前線維と神経節細胞の比を求めると副交感神経系ではこの比が小さい。ネコの毛様体神経節では、Wolfによると節前線維と神経節細胞の比は1:2であるという。交感神経系では、この比はもっと大きくなる。BillingmanとRanson(1918)はネコの上頚神経節で120000以上の細胞を計測したがその直下の交感神経幹には3800の有髄線維が含まれているだけであった。そうすると一つの節前線維に対する節細胞の割合は約32になる。神経節細胞の数や節前線維に対する比は、動物腫によって異なるし一般に体重に従って増加する。3個体のヒトの上頚神経節の計測からEbbesson(1968)は76万〜100万個の神経節細胞があると推定、節前線維に対する比は1:63〜1:196であるとした。Webber (1958)はヒトの腰部交感神経節について、この比を1:28〜1:183であるとしている。このような数値は以下のような生理学的データをよく一致する。即ち一般的に副交感神経系は局所的な作用を示すのに対し、交感神経系は全身的な反応を引き起こす(例えば皮膚の血管等)。もうひとつ重要なことは、副交感神経系はある特定の機能あるいは器官に関係する少数の神経細胞集団にまで分割できるということである。この点はおそらく脳神経で最も明らかであろう。たとえば、動眼神経核のある細胞集団(動眼神経副核)は眼球のある特定の筋にのみ分布する線維を出す。同様に唾液腺や涙腺もそれぞれ独特の細胞からの線維を受けている。このような区別は脊髄の中間外側核では非常にはっきりしないか、または全く存在しない。
脳神経に含まれる副交感神経の神経節は、例えば毛様体神経節や顎下神経節のように明確な集団を作っているが仙骨部から出る副交感線維の神経節あるいは消化管に分布する迷走神経の場合は、標的器官内に広く分散している。報告により差は大きいがネコの十二指腸では1cm2あたり49081個の神経節細胞がある(他の報告では12170個)。
末梢の自律神経線維 neuroeffector mechanisms
自律神経系の線維を受ける全ての器官は非常に細かい神経叢を有する。この神経叢の構成や、線維と効果器の構造(筋か腺)との関係を明らかにすることは非常に難しい。渡銀染色された切片の観察から多くの組織学者は、自律神経線維の終末は互いに癒合して終末の細胞膜につながるのではと考えた。神経叢と神経叢との間にある細胞は一般に介在細胞と言われるがその本態については議論が多い。この細胞は結合組織の細胞であるかも知れないし、シュワン細胞の様な支持細胞であるかも知れないが神経要素である可能性もある。
電顕観察が可能になるとこのような矛盾の一部は解釈を見た。
末梢の自律神経線維は、最小径約200Åと非常に細かい(従って光顕ではこれが神経細胞線維とまちがわれたものも理解できる)。無髄線維はシュワン細胞に被われLemmocytesと言われる。このような細胞の"槽"の中には多くの線維が入っている。このことはインパルスの伝導と関係するだろう。というのは、同じ槽の中に入っている線維の一つが脱分極すれば、他の軸索に影響すると考えられるからだ。Lemmocyteの中で神経細胞どうしが癒合するということを示すデータはない。Lemmocyte以外にも自律神経の神経叢には他の介在細胞も存在する。このような細胞はむしろ結合組織細胞に近い。節後線維の直径は0.3〜1.3μmと小さいのでインパルスの伝導速度も0.7〜2.3m/secと遅い。Falck-Hillarp法によりいくつかの器官に見られる神経いすにはnoradrenalinが含まれていることが分かった。即ちこのような線維は交感神経系の節後線維である。ノルアドレナリン終末の分布は器官によって異なる。他の線維はコリン作働性の副交感節後線維であることが、組織化学や電顕によるシナプス小胞の形態観察において明らかになっている。
交感・副交感の終末数の比は器官によって大きく異なる。例えばブタの虹彩では最も微細な終末はコリン作働性であった。15%のみがノルアドレナリン作働性である。後者は抑制的に働くと考えられる。同じ動物のalimentary tractではノルアドレナリン作働性の線維は括約筋に多く、他の部位では少ない。
自律神経系のインパルスがどのようにして効果器を興奮させるかという問題は、体性神経系における同様の機構よりもはるかに理解が難しい。未だ解決されていない問題が多いし見解の不一致も多い。小腸の組織内でノルアドレナリン線維の終末はしばしば副交感神経系の節後線維にシナプスすることが観察されている。これによって交感神経系が腸管の働きを抑制するのだという考え方もある。
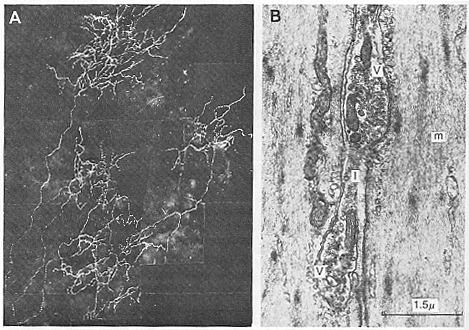
FIG.11-9 A: Theiris of the rat, 2 days following partial sympathetic denervation (Falck-Hillarp method). Since the great majority of adrenergic fibers have degenerated, the course of a single remaining fiber can be identified by its fluorescence. Note profuse branching of terminal fibers. The varicosities are not too clearly seen at this magnification. From Olson and Malmfors (1970). B: Two varicosities of a pstganglionic fiber forming close contact relationships with two muscle cells. Over half the surface of each varicosity (V) is covered by muscle (m) and separated from it by less than 200Å. Synaptic vesicles are seen in both varicosties and the narrow part (I) of the axon between them. From Bennett (1972).
自律系の終末が効果器の細胞膜に連続しているという考え方は今では信じられてはいない。終末と効果器の細胞との解剖学的位置関係を調べるのは大変困難な事であるし、すべての自律神経に支配される器官が調べられた訳でもない。最も良く調べられているのは平滑筋であるが、腺に関する情報もある。このような研究に最も適しているのは自律系線維の終末密度が高い組織である。例えばvas deferensや虹彩のような。ラットのVas deferensではシュワンを欠く無髄線維が筋線維の間を走っている。その終末や途中で線維は小さな拡張部を有しこれは筋細胞の膜に接している。他の器官例えば子宮や消化管では、この拡張部と筋との間には1000-3000Åの距離がある。拡張部(or varicosity)は小胞とミトコンドリアを含んでおり、いくつかの点で中枢神経系で見られるboutonsに似ている。ただし小胞の形態は異なる。
電顕的観察は自律系の線維を受ける器官には神経―効果器接合部と考えられる構造が存在することを示した。これは生理学的研究からBurnstockとHoman(1961)が到達した結論を肯定するものである。伝達物質の種類によってシナプス小胞の形態が異なることは一般に認められている。大型の有芯小胞については未だ不確かだが、小型の無顆粒小胞はコリン作働性ニューロンに小型の有芯小胞はノルアドレナリン作動物ニューロンに特異的である。例えば副交感線維の多いラットの虹彩では、無顆粒小胞を持つ終末が多い。これに対して有芯小胞は散大筋に認められる。しかし同一の終末に異なる型の小胞が存在することもあり、話はそう単純ではない。最新の研究方法による広汎な研究が行われているにもかかわらず、小胞の形態と伝達物質の関係は解決を見ていない。
自律神経系に支配される効果器は結局神経からの科学的伝達によって興奮することは認められているが、伝達物質の作用様式はまだ議論の的である。伝達物質は軸索を輸送され、シナプス部位において受容体と結合、さらに複雑な酵素反応系が関与する。アドレナリン作働性システムではαとβ受容体が区別される。α受容体は血管収縮、腸間の弛緩、瞳孔の散大等に関与する。また血管拡張(特に筋の)筋収縮力の増加、気管支の弛緩などはβ受容体によって伝えられる。ある化学物質や薬剤がα・β受容体のどちらかの一方に結合してその伝達を阻害するとうことは、臨床的な意味を持っている。たとえばβブロッカーは交感神経系の心臓に対する作用に拮抗する。このような阻害剤はその組織にもともと存在する伝達物質と受容体を競合すると考えられている。すでに述べたように節前線維の終末と副交感神経と一部交感神経の節後線維終末の伝達物質はアセチルコリンである。副交感神経の終末におけるアセチルコリンの作用はコリン作働性阻害薬であるアトロピンで抑制されることは以前から知られていた。抗コリンエステラーゼはこれと逆の作用を示す。節前線維の終末のシナプス伝達はアトロピンでは阻害されない。
アトロピンは以下のように臨床応用されている。眼科では瞳孔を散大させるために使用するし、気管支平滑筋の弛緩、腺分泌の抑制、胃の蠕動運動、胃液分泌の抑制を目的としても使われる。すでに述べたように、汗腺に分布する交感神経系の節後線維はコリン作働性なので、アトロピンは発汗を抑制する。ピロカルピンは反対の作用を持ち、唾液や涙、汗や消化管の腺分泌を促、瞳孔を収縮させるというようにコリン作働性線維に支配される器官の機能を促進する。このような効果は、アセチルコリンの分解を阻害するフィゾスチグミン(エゼリン)等の抗コリンエステラーゼの作用と同じである。
自律系のシナプス伝達に影響を与える薬物がいくつか知られている。このような薬物の作用は実験動物で確認され、人に応用されている。神経節のblockerや自律系に作用するその他の薬物を臨床で使用するときに重要なことは、薬物の効果が全身的に現れるということを知っておくことである。例えばmyasthenia gravisの患者に抗コリンエステラーゼを投与してdiarrheaやbradycardia等がみられる場合のように、多かれ少なかれ自律神経系の知識により予測できるような好ましくない副作用を経験することがある。
伝達物質の化学構造と役割に関する知識が集まるにつれ、自律系に作用する薬物の効果についての理解も進んだ。よく知られた現象についてもその理論的根拠が理解されるようになった。一方、神経化学や神経薬理学の進歩は、自律系の問題は複雑で機構も非常に込み入っているということを示してもいる。
交感神経の節後線維や交感神経節を摘出して交感神経支配を除いた場合、その標的器官では術後1-2週間のうちにノルアドレナリンやアドレナリンに対する感受性が高まることが知られている。例えばRaynaud病で星状神経節を摘出した場合、直接の影響は術側の頭頚部および上肢の血管拡張である。数日のうちにこれは目立たなくなり、術後1週間ぐらい経つと、例えば情緒的ストレスや寒冷暴露などアドレナリンが過剰に分泌されるような状況では明らかに血管が収縮する傾向をみせる。標的器官のアドレナリンに対する感受性が亢進することをsupersensitivityという。この現象はアドレナリン作働性神経系に限らず、コリン作働性神経系でも同様に見られる。節前線維の切断によっても感受性の増加も起こるが、これは臨床的には節後線維を切断したときよりも軽い。
自律系線維のdenervationによって起こる感受性の亢進は"row of denervation"のよい例であろう。一連の遠心路を構成するニューロンの一つを破壊すると、その遠心路の標的器官の感受性が亢進する。この感受性の変化がいかにして起きるかについて研究がなされているものの、一般的に受け入れられるような理論は見つかっていない。この現象は、交感神経系の手術以外についても臨床的興味のあるところである。術後の自律神経系のrecurrenceについては以下のような説明も可能である。すでにこの章で述べたように、交感神経系の節後線維は交感神経幹以降に存在する。Sympathectomyの場合のように、神経節細胞が残存していれば、節後線維が切断されたとしてもこの細胞から新たに線維の再生が起こるかもしれないし、intactな細胞から側幅路が形成されるかもしれない。納得できるようなデータを示すことが難しいので、この問題については過去様々な推測がなされた。さらに、例えばブラジキニンのような液性因子が特に血管の変化については重要な働きをしていることが指摘されている。最近の解剖学的・生理学的研究は、自律系の線維がかなりの再生能力を持っているというデータを裏付けている。
ほとんどの実験は頸部交感神経幹切断後の上頚神経節について行われている。このような手術後、ネコやウサギでは2-4週間後には機能回復が見られる。上部交感神経幹の切断後、上頚神経節内の殆どのシナプス終末は変成し消失するが、節後線維は殆ど変化しない。 Raismanは、節前線維が再生するに従い、神経節内のシナプスも1ヶ月後には再び現れ、2ヶ月後には、その数が正常に復することを示した。電子顕微鏡を用いた定量的研究によると、そのような手術を受けたラットの交感神経幹内の線維数は再生初期には非常に多く、約6ヶ月するとだいたい正常の数になるという。これは切断後の再生初期には、側副枝が過剰に形成されるが、余分なものは次第に消失すると言うことを示している。
外科的な交感神経切除の影響を評価する際は、節前線維の再生能力を考慮する必要がある。自律神経節を摘除した場合の節後線維の再生能力についてはよく分かっていない。器官による違いや種差もあるようだ。
ここまでは主に自律神経系の遠心性線維について述べ、求心性線維については所々でふれただけであった。臨床的には重要であるものの、求心性線維については余りよく知られていない。内蔵性の遠心性線維は人体の内部環境を一定に保つための様々な内蔵反射において重要は働きをしている。内蔵性反射というものは、単に内蔵性求心性刺激によってのみ引き起こされるのではなく、体性刺激やさらには前庭器官の刺激が吐き気を起こす場合のように、特殊感覚の刺激にも反応して起こるのである。内蔵性somatosympathetic反射についてはSato and Schmidt(1973)をみよ。脳神経に含まれる内蔵性求心線維(このネーミングには異論があるが副交感性求心線維と呼ばれる)は内蔵反射と関連した求心線維として重要である。迷走神経は痛覚の伝達には関与しないようだ。しかしながら味覚のようにある種の内蔵性求心性刺激は脳神経によって運ばれる。このような内蔵性求心線維の細胞体はそれぞれの脳神経の感覚神経節に存在する。迷走神経では主にnodose神経節に、舌咽神経ではpetrous神経節に、中間神経では膝神経節に存在する。詳細は7章参照。
そのほかの内蔵性求心性線維は交感神経繊維と同様の文節状分布を示し、脊髄に入る。このような線維は内蔵や血管にいたり、そこで終末分枝は感覚受容器となる。その形態は殆どの場合自由神経終末であるが、もっと特殊化された終末も見られる。腸管膜では例えばパチニ小体である。内蔵性求心性線維のあるものは痛覚を伝え、その細胞体は体性求心性線維のように脊髄神経節にあるということは今では一般的に認められている。内蔵にHRPを注入すると対応する脊髄神経節に標識された細胞を見ることができる。この求心性線維は、白交通枝を通って脊髄神経に至る。頚部、下位腰部および仙骨部では一部の線維は下位白交通枝を通って交感神経幹にいたり、これを上行あるいは下行して協文節や上部の腰部に至る。この線維に関する実験的研究は少ない。モルモットでは下腸管膜神経節からの求心性線維の細胞体は主にL2かL3にあるということがHRP法で示されている。また、下部結腸、膀胱、前立腺、子宮頚部などからの内蔵性求心性線維は仙骨神経の2-4に入るという。
内臓感覚受容器に関する実験的研究も少ない。その構造については殆ど何も知られていない。あるものは粘膜に存在し、化学物質の刺激を受容する。機械的刺激は主に筋層に分布する受容器が捕らえる。ネコの腸管にみられる機械的刺激の受容器は徐々に適応するものとon-of型のものがある。これらは小腸の収縮や人工的な刺激により刺激を受ける。腸管のパチニ小体からの線維は他の線維より太い。splanchnic神経を通る消化管からの求心線維のうち約40%は無髄であり、殆どの有髄線維は1-4μmと細い。後根神経節からの記録によって、ネコの内蔵神経の求心性線維の細胞体はTh9-11にあることが分かっている。小腸の機械的刺激の受容器はおおむね伸展受容器である。すなわちこの受容器は、腸管の内容を感知し、輸送するために重要なのである。
内蔵性求心線維の終止についてはよく分かっていない。おそらく脊髄後角の細胞あるいは介在細胞に終わり内蔵性遠心線維に終わることはなさそうだ。胸腹部の交感神経を切除すると脊髄の中間外側角の細胞に退行性変成が見られるが、後根を切除しても中間外側角に退行変成したシナプスは認められない。このようなことから、内蔵反射は多シナプス反射であると思われる。内蔵性刺激は脊髄の前外側を上行し、あるものは最終的に意識に上る。内蔵性刺激の上行路についてはNewman(1974)を参照。
自律神経系についての考察を続ける前に、少し生理学的側面を考えてみるのもいいかもしれない。自律系の生理は大きな分野で、近年情報量が増している。以下はそのいくつか。歴史的なremarksは興味を呼ぶ。
Langleyによって導入されたnicotine methodが自律神経系の生理学的研究に大きな進歩をもたらしたことは疑う余地がない。Langleyらは自律神経節にニコチンを適用すると一過性の興奮の後節前線維から節後線維への伝達がblockされることを見いだした。このとき神経節を素通りする線維は影響を受けない。すなわち、ニコチンは節には作用するが線維にはしない。この方法を用いてLangleyは星状神経節あるいは中頚神経節にニコチンを塗っても最上胸部の腹根刺激による瞳孔の散大は起こるが、上頚神経節に塗るとこれは起こらなくなることを示した。すなわち、瞳孔に分布する交感神経繊維は、星状神経節や中頚神経節ではニューロンを交代せず、上頚神経節で節後線維にシナプスすることを示したのである。同様な方法で、交感神経系遠心線維のシナプスの位置が決められた。さらにLangleyは交感神経系の節前線維を刺激すると、血管の収縮やpiloarrection、発汗などが起こること、また脊髄の髄節とそこからでる交感神経に支配される領域との関係を明らかにした。さらに大きな発見はある化合物が自律神経系や後に明らかにされたように中枢神経系においてもシナプス伝達を仲介すると言うことである。1921年にO.Loewiは迷走神経を刺激すると心臓からある物質が放出され、この物質は他の個体において迷走神経刺激と同様の生理学的さ用を示すことを観察した。この物質はアセチルコリンと同様の性質を持っていた。今では、この迷走神経由来の物質がアセチルコリンであることは広く認められている。交感神経刺激はアドレナリンと非常によく似た物質を放出させ、これはsympathinと名付けられた。これらの物質は、交感、副交感神経の節後線維の末端から放出される。Henly Daleは、コリン作動性あるいはアドレナリン作動性節後線維という広く用いられている名称を提案した。
この分野のパイオニア達によって発見された基本的原理を確認する一方、後の研究は自律神経系の作用機構にはより特異的なパターンがあることを示した。伝達物質について見ると、当初sympathinと呼ばれた交感神経系の伝達物質はアドレナリンではなくノルアドレナリンであることが解った(アドレナリンは内臓神経の刺激によって副腎髄質から分泌される)。上記の如く、ノルアドレナリンとアセチルコリンはそれぞれ形態の異なるシナプス小胞に貯えられているようである。汗腺や筋性の動脈に分布する交感神経系の節後線維がコリン作働性であるということは、解剖学的に区別される交感神経系と副交感神経系が必ずしも、それぞれアドレナリン作働性とコリン作働性のシステムに一致するものではない。こういう例はこの先さらに多くなるかも知れない。
最近の研究結果を考慮しても、一般的に交感神経系と副交感神経系は拮抗的に働くという古典的な考え方は基本的に支持されるべきだ。しかしこれは、絶対的なものではない。この原理は、副交感神経が蠕動運動の亢進や腺分泌を刺激する胃や腸管では正しい。唾液腺では副交感刺激は多量の粘液分泌を引き起こすが、交感神経刺激による唾液分泌については議論の余地がある。正常の状態では二つの系の働きは心臓の調節に見られるように統合されている。
二つの系は互いに協調して働くにも関わらず、例えば節前線維と節後線維の比のように重要な違いがある。すでに述べたように、節前線維の節後線維に対する比は、交感神経系におけるよりも副交感神経系の方がはるかに少ない。従って副交感神経の方が刺激の種類の多様性に富むと考えられる。このことは、多くの例外があるにしても、副交感神経系の作用は一般的に胃って局所的であるのに対し交感神経系の作用はむしろ全身的であるという生理学的な知見とよく符合する。臨床的立場から見て、あらゆる神経系の疾患の中で、自律神経系の乱れはありふれた疾病であるにもかかわらず、しばしば見過ごされてしまうということに気を付けるべきである。自律神経系の機能の入念な検査が貴重な診断上の情報を与えるかも知れない。
Vegitative tonusという言葉は自律神経系全体の状態を表す言葉として使われてきた。Tonus(緊張)は個人差があるし、同じ人でも条件によって異なる。Eppingerらは交感神経緊張症と副交感神経緊張症をその人が交感・副交感のどちらに起因する症状を強く示すかによって見分けることが出来るという。しかし多くの場合、交感神経系優位を示すサインは副交感神経の過緊張を示すサインと重複していることがある。単一の器官について見ると交感神経あるいは副交感神経系の優位をはっきりと見ることが出来る(局所的vagotonia or sympathicotonia)。Cannonは自律神経系の働きについて次のような考え方を提唱した。一般的にいって、副交感神経系は防御的であり体の蓄えを保つ方向に働く。副交感神経系は強い光から網膜を守り、消化管での腺分泌を高め、膀胱や直腸での排泄に関わる。これに対して交感神経系は運動、恐怖、興奮などのストレス時に体の蓄えを消費するように、すなわち緊急事態に対応するように働く。このようなときには内臓神経によって副腎髄質が刺激されその結果分泌されるアドレナリンが多くの身体機能の変化をもたらす。例えば、アドレナリンの交感神経刺激は心拍数を増加させ、気管支を広げ、血糖値を上げる一方消化管の運動と腺分泌を抑制する。これらはすべてストレス対応に適した反応である。交感神経系を摘除された動物は、隠れて住むようになり、通常の場所に引き出しても抵抗が少なく、適応力に欠ける。これはCannonの考えに一致する。しかし、Cannonの考え方も修正が必要ではある。彼の時代に考えられたよりも今では、自律神経系はもっと特殊化されたシステムだと考えられる。例えば交感神経系の機能も依然考えられたよりももっと局所的である。さらに強度のストレスあるいは緊張状態では好ましくない自律神経反射が起こることがある。例えば、心拍数の減少、意識の喪失、膀胱や直腸の括約筋群の弛緩なとであり、これらの反応は、恐怖やストレス時に見られる一般的な交感神経症状と矛盾する。ストレス時に観察される現象は、個体の中で起こる非常に複雑な変化の一部にすぎない。ストレス反応は、生体のすべての反応を制御・整合する中枢神経系を取り込んだ反応であり、この点における中枢神経系の働きは内分泌系と密接な関係がある。
Central levels of autonomic regulation. The hypothalamus.
前章で見たように自律系の機能は大脳皮質、海馬、嗅内野、視床の一部、基底核、網様体、小脳など脳の様々な領域からの影響を受けている。これらの作用の多くは視床下部を介して行われる。この部位は脳内の様々な部位と直接・間接に連絡を持ち、自律機能の統合を行う部位であると考えられている。視床下部の統合機能は、一つにはここから発する遠心性線維によって可能となる。この線維は脳幹や脊髄にある自律系の節前線維へ連絡する。また視床下部は神経線維あるいは血管系を介して下垂体と密接な関係をもっており、これによって視床下部の内分泌系への働きかけが可能となっている。この領域における知識の増加はneuroendocrinologyという分野を生みだし、この分野は着実に拡大している。
視床下部は自律機能の最高中枢であると考えられているが、多くの自律機能にとって視床下部の存在は必須ではない。自律系の統合機能は脳幹にも存在する。例えば心や呼吸の調節は橋の上部で脳を切断された個体でも機能し続ける。このような統合センターは延髄から中脳に至る、いわゆる脳幹網様体にあると考えられる。先に記載したように、この領域から直接あるいは間接に脊髄へ至る神経路があり、これらの線維は直接脊髄の中間外側角の細胞にシナプス結合はしないのであるが、統合センターからの刺激を末梢に伝える。通常呼吸機能や心機能の変化は単独に起こるとういことはなく、様々な刺激に反応して起こる一連の自律機能の変化の一つとして起こるのである。例えば心機能の変化は、消化に伴って起こるし、体温調節や運動、性機能などと関連して変化する。このような状況下で自律系の線維を受ける器官が示す様々な変化には視床下部は関与しない。視床下部の構造と機能に関する情報が最近急速に増えてきた。以下主に、視床下部及び視床下部と他の脳の領域との線維結合に関する解剖学的なデータについて述べることにする。
視床下部は視床下部溝より下の第3脳室の壁を構成する組織で、脳全体から見ると非常に小さな組織である。視床下部とその隣接する組織との境界は、特に外側と尾側で不明瞭である。このような領域の多くは例えば中隔核のように視床下部との間に線維連絡がある。自律機能にそれほどの種差が見られないのと同様、視床下部にも動物種による大きな違いはない。図11-10にLe Gros Clark (1938)の研究に基づく簡単な視床下部の模式図を示す。視交叉の後方には下垂体に続く漏斗がある。視床下部底部は後方では大脳脚の内側に一対の乳頭体を作る。第3脳室の壁と底部は少量の線維束を含む灰白質からなる。太い線維束である脳弓は乳頭体から前上方へ向かう。比較的小型の細胞を含む灰白質は上衣細胞直下にまで分布する。このsubstantia grisea centralis (中心灰白質)にはいくつかの神経核が区別される。
この中の一つが視索上核であり、この名称はこの核が視索の上部に位置することかに由来する。この核の細胞は比較的大きく球形である。同型の細胞は室傍核にも見られる。けれらの核は他のいくつかの核と共に視床下部のanterior groupを構成する。人では一側の視索上核は平均75500の細胞を含み、室傍核は55000の細胞を含むという。
視索上核のすぐ後方には、nucleus tuberisと呼ばれるいくつかの小型の神経核群が存在する。これらの核は小型の多極性細胞を含み、霊長類に特異的に認められる。背内側核、腹内側核、視床下部外側核などは小型あるいは中等大の細胞を含み、tuberal nucleiとともにmiddle nuclear groupを構成する。Posterior groupは乳頭体とその上方に位置する神経核(posterior hypothalamic nucleus)からなる。乳頭体は小細胞性の内側乳頭核と外側核に分けられる。小細胞性の部分はanthropoidsとヒトで発達が良い。Posterior hypothalamic nucleusはおおむね小細胞性で少数の大型細胞が散在性に見られる。視床下部のsubdivisionについては研究者により異説がある。これについてはChrist(1969)の総説を参照。
Szentagothaiら(1968)はGolgi法によって視床下部を観察し、軸索や樹状突起のことなる多くの細胞群を分類した。彼らは視床下部内部の線維連絡についても研究し、内側部とが外側部で明確な違いがあるとした。また彼らは、主軸索によって視床下部を離れるインパルス以外に、興奮は視床下部内側部の神経線維網を伝わりclosed self-re-exiting chainsを形成すると結論した。この局所的な線維網は外側核にはない。この領域の大細胞群は離れた部位に投射するようだ。一方、視床下部への求心線維は、その殆どが外側核に終わる。これらの線維は進化的に古い構造である内側前脳束を通る。
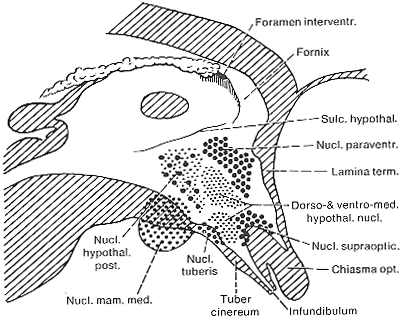
FIG.11-10 Diagram of the ventricular surface of the hypothalamus in man, showing the position and extent of the most conspicuous hypothalamic nuclei (see text). Slightly modified from Le Gros Clark, Riddoch, and Dott (1938).
最近、視床下部のchamical anatomyに関する研究が多く報告されている。視床下部は脳の中で最もアドレナリン濃度の高い領域であるし、アセチルコリン、セロトニン、ドーパミン、ヒスタミンなども認められる。これらの分布は均一ではない。
例えばノルアドレナリンは室傍核や背内側核、retrochiasmatic areaに多く、ドーパミンは多かれ少なかれすべての核に存在するが、特にこの3つの核に多い。セロトニンは後核に多い。アセチルコリンエステラーゼを指標とすると、アセチルコリンは腹内側核をはじめとするいくつかの核に特異的で他の核には見られない。
視床下部の諸核に見られる伝達物質がその核のニューロンに含まれるのか、その核に投射する線維に含まれるのかは全く分かっていない。背内側核のノルアドレナリンは少なくとも青班からの線維を相当含んでいるようだ。視床下部のドーパミン濃度はtotal hypothalamic deafferentationでも変化しないので、殆どの視床下部ドーパミンニューロンは視床下部内の核に投射するらしい。ノルアドレナリン作動性及びコリン作動性の線維結合については恐ろしく複雑なmapができているが、ここではこれ以上ふれないことにする。
視床下部の諸核はその境界がはっきりせずまた線維結合も複雑である。このことは視床下部のある特定の領域と機能を結びつけるときに特に注意しなければならない。この問題は後述するとして、視床下部の機能を考えるとき最も重要なのは、視床下部と脳の他の部位との線維連絡を理解することである。
視床下部は小さな領域でしかも多数の小型の神経核が存在しており、線維連絡の研究は困難であった。従って、成果も乏しい。視床下部の求心性・遠心性線維の多くは内側前脳束を通る。内側前脳束というのは古くから用いられた言葉で、前方は前交連に始まり、parasagitallyに走り後方は中脳に達する。基本的にこれは、前脳底部と脳幹を結ぶ線維束である。内側前脳束の成分に関係する細かい研究は困難であった。しかしながらこのような研究から内側前脳束を構成する線維は細かく中隔核や視床部及びこれに隣接する核の相互の連絡にあずかるということが解ってきた。図11-11に、視床下部中心の線維連絡を示す。
視床下部の求心性線維を調べると、この部位が脳の多くの部位からインパルスを受けていることが解る。これは生理学的研究からも指摘されていたことでもある。さまざまな感覚情報も直接視床下部に入力する。網膜からの線維が視床下部に入るかどうかは長い間論争の的であったが現在はその存在が確立されている(autoradiograph法で確認された。これらの線維は一部交叉し現在までの所少なくとも視交叉上核に入ることが知られている)。
網膜からの線維が視床下部に入力するということは、光刺激が視床下部に影響を与えるということを示している。これは、光りが性周期や既日リズムに関係することを裏付けている。
嗅覚刺激も少数であるが視床下部に直接入力、外側の領域に終わり、この細胞を興奮させる10章で述べたように、嗅覚刺激は、扁桃体や梨状皮質を介して、間接的にも視床下部に入る。生理学的には聴覚や皮膚刺激及び内側毛帯の刺激に伴う視床下部の電位変化が報告されているが、これらのインパルスの経路についての解剖学的基盤ははっきりしない。脊髄の後角との連絡は不明だが、Kerr(1975)はventral funiculusを上行し視床下部後内側部へ入る線維を見ている。脳幹網様体の線維の一部は視床下部まで追うことができる。その他視床下部は、青斑核や縫線核からの線維を受ける。これらのうちのあるものは正中隆起まで届く、中脳のdorsal and deep tegmental nucleiの線維は乳頭体や外側部に入力する。小脳からの線維もあるようだ。弧束核から室傍核、背内側核、弓状核へ投射があることは興味深い。
視床下部はより"上位"の脳からも入力をうける。海馬対の線維は主に乳頭体に入るが、別に、中隔核を介して入るものもある(→10章)。しかし、基底核からの線維は証明されていない。視床からの線維はいくぶんあるようだ。新皮質からの入力は不明Lundberg(1960)やSzentagothai(1962)はないと言っている。しかし、Nauta(1962)はサルでorbitofrontal cortexから視床下部への線維を証明している。これは特に外側部に入る。Cortexから視床(背内側核MD)経由で視床下部に来る線維はあるようだ。
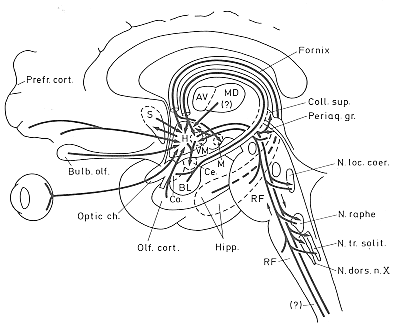
FIG. 11-11 Simplified diagram of the main afferent and efferent connections of the hypothalamus. See text for particulars. The connections of the mammillary body and the hypothalamohypophysial projections are not included. Abbreviations: BL, Ce.,and Co.: basolateral, central, and cortical amygdaloid nucleus, respectively: H: hypothalamus; M: mammillary body; MD: Dorsomedial thalamic nucleus; RF: reticular formation; S: septum; SN: substantia nigra; VM: ventromedial hypothalamic nucleus.
まだ確定的ではないが以上のように視床下部は、他の全ての脳領域と直接、間接の線維連絡を保っている。様々な入力はそれぞれ独自の部位に終始するようだがこのことについてはよく分かっていない。求心線維と同様視床下部の遠心線維も脳の様々な部位に投射している。次項で述べる下垂体路を別にすると視床下部の遠心性線維には以下のようなものがある。
視床下部の遠心性線維はある程度求心性線維と同様の部位を結ぶと考えてよい。上位性の中では乳頭体から視床前核へ行く乳頭体視床束が最も顕著である。あるものは扁桃体へあるものは中核核へ入ることが知られている。海馬へも、これは乳頭体隣接部の細胞からでる。視床枕へという路もある。もっとも興味深いのは交感・副交感神経の節前線維へ連がる神経路である。トレーサー法の改良がなされる以前、この経路は多シナプス性だと信じられていた。最近では、視床下部の主に腹内側核からの線維が中脳水道周囲の灰白質に至ることが解っている。他にも視床下部線維はperfectal area, 上位、guddenの背・腹側被蓋核、青斑核へ行く。乳頭体被蓋路は乳頭体から中脳毛様体へ投射。
最近の研究は視床下部から内蔵神経の節前ニューロンへ行く神経路の存在を確認している。ネコの脊髄にHRPを注入して、Kuypersは視床下部背側部に標識細胞を証明した。ラット、ネコ、サルにおいて、Saperらは、室傍核、外側背側核、背内側核外側部の細胞が脊髄に投射することを示した。視床下部脊髄路の起始核はこのように散在しており、その線維はおおむね同側性に下行する。このような投射線維の終始核は、トリチウム標識されたアミノ酸のトレースにより明らかにされた。この方法によると視床下部からの線維は、迷走神経背側運動核、弧束核、疑核、及び脊髄の中間外側核に終わる。とは言っても視床下部の影響が間接的に中間外側核に達する経路は当然存在するはず。視床下部由来の線維と内臓性遠心性ニューロンとの直接のシナプス結合は未だ証明されておらず、EMの研究が必要である。
視床下部性下行線維と節前線維の関係には電気生理学的研究も行われているが、要するによく解らない、腹内側核はfeedingや affectiveに関係する核で、ここへの入力は主に扁桃体から入る。ゴルジ法で見ると腹内側核の細胞は分岐しない長い樹状突起を持ちこれには多くの棘がある。この樹状突起はVMH外までのびている。電子顕微鏡学的に扁桃体からのニューロンは棘に終わる。
中枢神経系特に視床下部の障害が、本来内分泌系によって制御されている機能の変化を伴うという事実は古くから臨床的に経験されてきた。しかしながら内分泌系の器官の中で、自律神経系により主要な制御を受けているのは副腎だけである。従ってストレス刺激的に副腎皮質の反応はほとんど即座におこるが、他のシステムはもっとゆっくり反応する。後者の多くは性腺や副腎皮質、甲状腺等に対する下垂体前葉ホルモンの作用を介するからである。このあたりの機構が最近明らかにされつつある。視床下部は多数の線維を下垂体後葉に送っていること、および下垂体門脈系という視床下部と下垂体前葉を結ぶ血管系の存在によって下垂体前葉は視床下部の支配下におかれることになる。以下視床下部下垂体系に関する解剖学的知見およびこれに関係する生理学的データを示すことにする。
Cajalらはすでに視床下部の線維が下垂体茎を通って下垂体に至ることを記述している。この線維は無随線維で、サルで40000、ヒトで100000本にもなる。実験的下茎切断によって退行性変性は主に視索上核、室傍核に及んだ。これは治療目的で下垂体を摘除された多くの患者の脳を調べることでヒトでも確認された、術後1年後には、視索上核と室傍核のニューロンの85%(ラットや犬でもだいたい同じ)が消失した。すなわちこれらの神経核のほとんどの細胞が(近年HRP法で確認されたように)下垂体に線維を送っている。視索上核PVNの線維束はまとめて supraoptico-phypophysial tractと呼ばれている。
下垂体は前葉(腺性下垂体)と後葉(神経下垂体)からなる。前者は発生学的に原始口腔から生じたラケト嚢に由来し、後者は神経管に由来する。前葉は主部と隆起葉にわけられ、後者は正中隆起部、漏斗茎、神経葉に分けられる。前葉には多種の細胞があり毛細血管網が発達している。HE染色によって、前葉細胞は一般的に好酸性細胞と好塩基性細胞にわけられる(嫌色素性も)。さらに細かい分類も可能である。最近のデータは下垂体ホルモンの数だけ細胞種がある。即ち一細胞が一種のホルモンを出すということを示している。
((現在は、LHとFSHはおおむね同じ細胞から分泌されると考えられている。またヒトのACTH細胞は好塩基性である))
好塩基性細胞にはFSH,LH,TSH細胞が好酸性細胞にはGH,PRL細胞が含まれる。ACTH細胞は嫌色素性と信じられている。後葉の主な細胞はpituicyteである。これは一種のグリア細胞であり機能は不明、電顕的には神経分泌顆粒をもつ終末がこの細胞に接している。この線維はPVNやSONからのもと思われる。さらに視床下部の他の部位から発する視床下部下垂体線維がある。これらは隆起核とよばれる一群の核から出る。漏斗核あるいは弓状核は漏斗の中にまで広がっている。この部位は一般にhypophysiotrophic areaと呼ばれる。この部位からの線維はtuberohypophysial (Tuberoinfundibular) tractを通って下垂体へ至る。
Hypophysiotrophic areaは明確なoutlineをもたない。SCN,PVN anterior hypothalamic premammillary nuclei, and medial half of VMHがこれに入る
下垂体茎を切ってもこれらの核に退行性変性はみとめられないので、これらの線維の起始核を特定することは困難であった。これはつまりsupraopticohypohysial tractと違い、tubero hypophysial tractは正中隆起よりも先へは伸びていないからであった。視床下部下垂体線維は下垂体前葉までは至っていないということは極めて重要である。
これらの線維(視床下部-後葉系の線維)は一部中間葉に入るものの全てが後葉へ入る。今では上記の如き2種の視床下部下垂体線維が存在するという事が確立されている。神経葉への線維はバゾプレッシン、オキシトシンという後葉ホルモンの分泌を行い。正中隆起へ向かう線維は門脈を介して、前葉ホルモン分泌に関係する。この2種の線維の解剖学的特徴について以下にのべることにする。機能的には異なるもののこの2つの視床下部下垂体系線維は神経分泌を行うという点では同じである。これらの系に属する細胞は、全く神経細胞であり、軸索や樹状突起をもち、Nissl小体や他の細胞内小器官を持つ。他の神経線維刺激により興奮し、軸索を輸送して運ばれた物質を終末で放出する。このことはSONとPVNの細胞で最初に証明された。神経分泌機能に関する歴史には興味深いものがあり以下これを少し考えてみよう。
事の起こりはScharrerによるコロイド滴の記載である。彼はコロイド小滴が細胞質や細胞外に認められ、これは様々な動物種で同様であるとした。Scharrerは、これは分泌物でありこれを含む神経細胞は神経分泌細胞であると考えた。Gomori'sヘマトキシリン−フロキシン染色によりBargmannはこのコロイド滴を染色し、これが視床下部下垂体線維の軸索内を輸送されることを示した。時にはこの物質は後葉の血管中にも証明された。下垂体茎を切断すると、この物質は断点よりも視床下部側に蓄積し、末梢側では消失した。また、位相差顕微鏡を用いてHildは培養後葉線維中をコロイド滴が移動することを認めた。神経分泌ニューロンの終末部と後葉の血管との関係は、さらに研究が困難であった。ヒト下垂体の渡銀標本でHagenはこれらの線維の終末は小さな膨らみをもって、血管に終わることを発見した。このことはBodian(1951)によってopossumでも確認された。Hagenによって発見された線維終末の膨らみの中にはGomori染色で染まる物質が入っていたのであるこれが軸索中にあり大きく固まったものがヘリング小体である。opossumで初めて認められたこの事実はBodianによりさらにヒトやサルでも確認された。
電顕で見るとこのGomori染色される物質は直径500〜2000Åの分泌顆粒の塊であった。もう一腫類300Åの顆粒をもつ終末もある。EMによる研究はさらに、この終末と血管の間には脳の他の部位では存在するグリア細胞が存在せず、終末は血管周囲のコラーゲン層に終わっていることを示した。時折分泌顆粒をコラーゲン層に見ることができる。またPalayは後葉の血管は有窓性であることを見つけた。
このような事実に基づいて考えてみるとおそらく分泌物を含むコロイド小滴はSONやDVNの細胞体で作られ視床下部下垂体路の軸索中を輸送されて後葉に達すると考えられる。後葉で初めてこの物質は血中に入る。小滴は後葉ホルモンあるいはその前駆体を含んでいるのである。後葉ホルモンは哺乳類ではオキシトシンとバゾプレッシンの二種である。オキシトシンは子宮筋の収縮、乳腺の筋上皮細胞の収縮(乳汁分泌)あるいは分娩、輸精管、女性生殖器でSpermの輸送を行う。バソプレッシンは小血管や腎尿細管にゆく、前駆体とはニューロフィジンと結合したものである。ニューロフィジンはオキシトシンやバソプレッシンと同じ細胞で作られる。
初期の研究はすでに下垂体茎の切断や後葉の破壊は尿崩症をひきおこすことを見ている。療法とも抗利尿ホルモンの産生をストップさせるのである。視床下部のうちPVNとSONにのみこのホルモン活性が検出される。Hariisは(1947)ウサギでSONやspraopticohypophysial tractを電極刺激すると尿量が低下すること及び、発情期のメスではこの刺激が子宮筋を収縮させた。これは多くの後の研究によって確認された。動物を口渇状態に数日おくと"染色される物質"が視床下部から消失した。これは多量の食塩を投与した時と同じ反応である。このような場合バソプレッシンの重要性が高まる。
近年、神経分泌メカニズムに関する電顕、電気生理、生化学的知見が集積されてきた。さらに最近では免疫組織化学やRIAが有効な手段として使われている。このような研究の結果、神経分泌顆粒の軸索内輸送は思いのほか早いこと(3mm/h)、顆粒の分泌は開口分泌によること等が解った。また後葉ホルモンの一部は門脈に入り前葉に影響を与えるがこれはspraopticohypophysial tractの線維が正中隆起に終わる場合があるという解剖学的知見と一致している。
視床下部の2つの神経内分泌核即ち、PVNはオキシトシン分泌に、SONはバゾプレッシン分泌に関係するということを示す良い証拠がある。実験的にPVNに傷害を与えると後葉のオキシトシン含量が低下する。このような考え方は、ある条件下では二種のホルモンが独立した分泌パターンを示すという事実をよく説明できる。即ち、乳頭の吸引刺激は主にオキシトシンを分泌させ(口渇−脱水)はバソプレッシンを分泌させる。
((現在は、PVNもSONも共にOXTとVPの2種のホルモンを分泌することが解っている))
多くの研究が視床下部は飲水・水分調節に重要な領域であることを示している。Andersson(1957)はヤギを用いて、前視床下部刺激は飲水行動を誘発することを示した。その後、多くの実験が口渇中枢を特定するために行われることになる。結局fitzsimons(1966)は、視床下部は飲水行動に重要ではあるが口渇中枢といったものは、餌や水の摂取を調節する大きなシステムの一部ではないかと結論した。感情の変化、血液量の変化など様々な刺激が水の摂取を増加させることが知られているが、これらの刺激の作用メカニズムは全く解っていない。ある条件では、体液の浸透圧の上昇は有効な刺激となる。
Verney(1947)は大動脈血の浸透圧は、バソプレッシン分泌に影響することを示し、視床下部には浸透圧をモニターするOsmoreceptorがあると考えた。Verneyは、Osmoreceptors は視床下部前部のSONあるいはその近傍にあるとした。VincetらはSONあるいは近傍の部位の浸透圧変化に対する反応からOsmoreceptor 細胞はこの部位に存在するが、それらの軸索は後葉には投射しないとした。Osmoreceptor細胞はSONの周辺部あるいは隣接する領域にあり、この細胞とSONの神経分泌細胞の間には複数のシナプスが存在するようだ。
解剖学的データはSONがOsmoreceptorとして適していることを示している。つまりSONとPVN、とくにSONは血管にとむ。血管網の密度は脳のどの部位よりも濃い。血管を染色した切片では当該核が肉眼的に見分けられる程である。各々の細胞は血管にとりまかれており、その間にgliaは存在しない。ある細胞では、細胞質の中を血管が貫通している像もみられる。この部位の血管は内頸動脈あるいはその枝の直接の分枝で、SON細胞は浸透圧の変化に対応してAVP(バゾプレッシン)を分泌するために適した状態にある。AVP分泌調節の詳細は解っていない。SONへの求心線維は主に脳幹からのmonoamiregic、他にはmedial basal hypothalamus, 扁桃体, septum、海馬などから来る。つまりSONの機能に影響を与える領域は多い。
ヒトでの観察は基本的に実験的データと一致している。視床下部の傷害は尿崩症を引き起こす。多くの場合、前視床下部の病変と関連する。
前述の様に化学構造的にバソプレッシンと近縁のオキシトシンは主にPVNで作られる。オキシトシンの子宮筋や乳腺に対する作用は良く研究されている。オキシトシンは乳腺終末をかこむ筋上皮細胞(これは神経線維をもたない)に作用しこれを収縮させることにより射乳を引き起こす。PVNの電気的刺激は射乳を引き起こすが、下垂体茎を切断しておくとこれは起きない。赤ん坊の吸引刺激による射乳には神経的、内分分泌的反射がかかわっている。求心性部分(反射弓の)は肋間神経を介する知覚線維である。これは乳頭吸引刺激を脊髄に運び、その後の経路はよく解らないがインパルスは結局PVNに達しオキシトシンを分泌させる。授乳期間中は多くの母親が吸引刺激がなくても射乳反応がおきることを経験している。授乳しようと考えるだけでも射乳が起こる。このように射乳反応は、上位の神経系の影響を受けているのである。想像は何らかの経路で視床下部に刺激を伝えるはずであるがこれについては何も解っていない。
下垂体茎切断、または下垂体摘除により切断されたsupraopticohypophysial tractの線維が新たな終末を生じるという現象は理論的にも臨床的にも興味がある。再生した血管との間に作られる新たな神経−血管結合はいわゆるminiature neural lobeを作ることになる。この組織的再生は行利尿機能の再生を伴うのである(Raisman 1973b等参照)。
要約すると、以前は後葉ホルモンと考えられてきたバソプレッシンとオキシトシンはそこでは作られず、視床下部のPVN、SONで作られる。ホルモンは軸索流によって細胞体から神経葉中の終末に運ばれ放出される。これは有窓性の内皮を通って血流に入る。視床下部の下垂体前葉に対する影響はこれとは異なったルート即ち血流を介し行われる。Supraopticohypophysial tractの線維と異なりこのような線維は正中隆起までしか達しない。これらの線維はまとめてtubero infundibular tractと呼ばれる。ゴルジ法及びその他の実験的手段により、SzentagothaiらやHatszらは、正中隆起へ投射する線維の多くは視床下部の第三脳室の基底部、特に弓状核から来ると考えた。他には視交叉上核とPVNからも入力がある。弓状核の一部の細胞は、視床下部腹内部に投射しておりこれは生理学的事実と一致する。最近の研究では、脳幹の青斑からのNA neuron、背側縫線核からの5HT neuron,及び、孤束核からのneuronが正中隆起に終止することを示している。
下垂体門脈系は、PopaとFielding(1930)によって発見された。彼らは下垂体前葉に至る血管に注ぐ洞様毛細血管網を下垂体茎と正中隆起において観察した。下垂体前葉ではこの血管は再び毛細血管網となる。つまりこの血管はstalkと下垂体前葉で二度毛細血管網を作るので下垂体門脈と呼ばれる。この門脈系を血流が上行するのか下降するのかは、当初不明であったが、生きた動物の門脈の観察からGreenとHarrisは正中隆起から下垂体前葉に向けて血液が流れることを明らかにした。これは、下垂体門脈系の機能を考える上できわめて重要である。下垂体周囲の血管系は、neoprene latexを用いた鋳型標本で詳細が明らかにされた。下垂体は内頸動脈から2系統の動脈の供給を受ける。上下垂体動脈は後内側方向へ走り、下垂体茎の最上部で動脈輪を作る。上下垂体動脈の枝は一部視神経、視床下部あるいはtrabecular arteryとして前葉へ至るが、大部分はロート茎に入る。trabecular arteryは下降して前葉に入るが前葉内であまり分枝しないらしい。もう一つの内頸動脈の枝である下下垂体動脈は、後葉の周りに動脈輪を作り、そこから茎の下部まで枝を伸ばす。
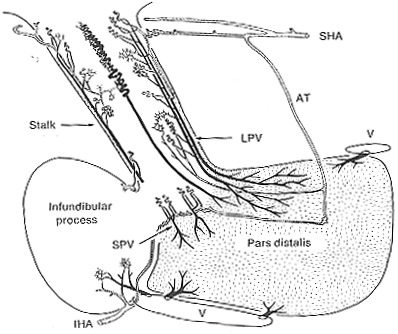
FIG.11-12 Diagram illustrating the vessels of te hypophysial portal system in man. The portal vessels leading from the sinusoids in the hypophysial stalk to the anterior are are shown in black (see text). abbreviations: IHA and SHA: Inferior and superior hypophysial arteries; AT: trabecular artery; LPV and SPV: long and short portal vessels, respectively; V: veins. From Adams, Daniel. and Prichard (1965-66).
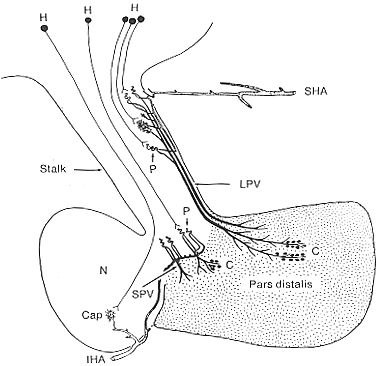
FIG. 11-13 Diagram showing the suggested pathways by which nerve cells in teh hypothalamus (H) transmit neurohumors via their axons into loops of the primary capillary bed (P), and thence through the long (LPV) and short (SPV) portal vessels to control the output of hormone from cells (C) in a given area of the pars distalis. The innervation of the capillary bed (Cap) in the infundibular process by nerve cells in the hypothalamus is also shown. Compare with Fig.11-12. From Adam, Daniel, and Princhard (1965-66).
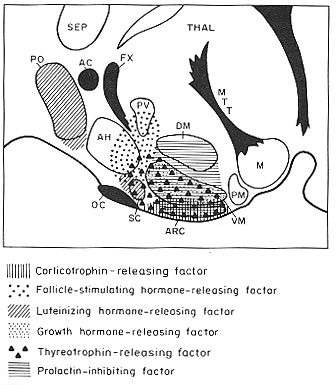
FIG. 11-14 Diagrammatic representation of a sagittal section throughthe hypothalamus, showing the areas that have been implicated in the elaboration of some relasing- and inhibiting factors (see key below figure for symbols). Some major fiber bundles are indicated in black, and some of the main hypothalamic nuclei are outlined. Based on illustarations of Bernardis (1974). Abbreviations: AC: anterior commisure; AH: andterior hypothalamic area; ARC: arcuate nucleus; DM: dorsomedial nucleus; FX: fornix; M: mammillary nuclear complex; MTT: mammillothalamic tract; OC: optic chiasma; PM: premammillary nucleus; PO: preoptic area; PV: paraventricular nucleus; SC: suprachiasmatic nucleus; SEP: septal nuclear complex; THAL: thalamus; VM: ventromedial nucleus.
重要なことは、下垂体前葉への血流の殆どすべてが下垂体門脈に由来することである。下垂体茎にはいると下垂体動脈は、細かな血管網に分かれる。上下垂体動脈は下垂体茎上部で、下下垂体動脈は茎の下部で血管網を作る。これはその後門脈にまとまり、前葉に至って再び毛細血管網となる。上下垂体動脈に由来するlong portal vesselと下下垂体動脈に由来するshort portal vesselを区別することができる。後者は下垂体茎に隣接する前葉の一部に主に分布する。両者の分布域の違いは、茎切断の時問題となる。
下垂体茎切断は乳癌の治療の目的で下垂体機能を不活化するために下垂体切除の代わりに行われた。下垂体茎の切断はしかし、上部の(long)下垂体門脈のみを切断し、下部(short)の門脈は保存される。したがって下垂体の一部は壊死を免れることになるが、視床下部との機能的連関は損なわれる。
視床下部が下垂体機能に影響を与えるということを示す生理学的な証拠は非常に多い。Harrisは視床下部後部と隆起部を刺激するとACTHの分泌が起こることを示した。下垂体を直接刺激しても何も起こらない。一方、茎切断を行うと性周期が停止するし、視床下部後部の切断はストレスに対応したACTH分泌を抑制する。このような多くの研究の結果、視床下部ホルモンは正中隆起で下垂体門脈に入り、下垂体前葉に至る。そして視床下部ホルモンの作用を介して下垂体前葉のホルモン分泌に対する中枢神経支配が成立するという概念が樹立された。このメカニズムは、しかし当初考えられたよりも遙かに複雑であることがその後の研究により明らかにされている。
神経伝達物質、酵素、ホルモンなど驚くほど多くの化学物質が視床下部に証明された。そのいくつかは、視床下部内の局在も研究されている。弓状核その他のニューロンから門脈に分泌される神経分泌ホルモンは、releasing factor(放出因子)と呼ばれる。神経分泌活性は視床下部以外の部位からの正中隆起への入力によっても制御されているようだ。放出因子として働くホルモンの他に最近はinhibiting factorも同定されている。これらの因子の名前は、作用を及ぼす前葉ホルモンの名前と関連づけてつけられている。例えば、corticotropin-, luteinizing hormone, follicle-stimulating hormone, thyrotropin, growth hormone-releasing factor, あるいはsomatotropin- and prolactin-inhibiting factorsといった具合である。このような物質の化学構造はまだよく分かっていないが、多くは小ペプチドであるらしい。視床下部のどの部位がどの放出因子を産生するかと言うことについても様々な方法で研究されているが結論はでていない。(この辺はその後の研究の進歩が著しい。ここでは適当に省略した)
上述の視床下部による内分泌機能の調節に加えて、視床下部の持つもう一つの重要な機能について記載したい。すなわち自律神経系による影響を受けるある特定の機能の調節に関わる"center"についてである。脳幹には、呼吸、心血管、嘔吐などの中枢があるが、以下視床下部に存在するとされている自律系の中枢について考えてみたい。すでに指摘したように、それらの多くは下位の中枢を介して作用を表す。実験動物において、視床下部の様々な部位を刺激したり損傷を加えたりする事により、多くの自律機能に変化が生じることが知られている。人における研究からもある程度の情報が得られている。自律神経領域に見られる影響はより複雑な変化の一断片に過ぎないことに注意すべきである。
既に明らかにされてきたように、視床下部の刺激は心血管系の機能に影響を与える。視床下部の後部を刺激すると、血圧の上昇や心拍数の増加が見られる。これに対して、視床下部の前部の刺激は血管の拡張や血圧の低下を引き起こすらしい。視床下部からのこれらの刺激を伝える経路は、明らかではない。
視床下部は体温調節にも重要な働きを示すようだ。初期の研究者は、前視床下部領域を局所的に加熱することにより全身的な体温低下が起こることを示した。これは視床下部には体温調節機能が備わっていることを示している。この機能により動物の体温は一定以上に上がらないようになっている。この領域を量側性に破壊すると、暑い部屋においても汗をかかなくなり体温が上昇する。この変調は時間がたつと多少改善されるものの基本的には回復しない。これとは逆に、視床下部後部すなわち背外側から乳頭体にかけて両側に破壊すると動物は低温への順応ができなくなる。つまり低温環境においても震えたり血管を収縮させたりしなくなる。このような実験から、前視床下部の外側は熱の放散に関係し、後部視床下部は熱の産生に関係するらしいと言うことが解る。しかしこのような機能に関わる神経核は不明。さらなる研究が必要。
視床下部のある種の細胞は加熱あるいは冷却に反応し、温度レセプターとして働くことが解っている。そのような細胞は、前視床下部にある。発熱物質は前視床下部に注入されたときのみ発熱を引き起こす。従ってこの部位は、体内のサーモスタットの主要な部位である様だ。体温の上昇が必要なときは、視床下部の後部が活性化される(後部視床下部には、温度感受性はないらしい)。最近体温調節の化学的側面に注目が集まっている。アドレナリン。ノルアドレナリン、ドーパミンなどのカテコラミンは、前視床下部に注入された場合帯温厚かを引き起こすが、セロトニンは逆に体温を上昇させる。体温上昇が必要な場合前視床下部の細胞がセロトニンを放出、これが体温上昇のための一連の反応を刺激する。一方、体温低下が必要なときは他の細胞がカテコラミンを放出し体温を下げると考えられている。体温調節の中枢性調節機構はまだ不明の点が多い。視床下部以外の領域の関与も考えられる。視床下部のある領域は、皮膚感覚ばかりではなく菌毒素やモルヒネなどの化学物質にも反応するらしい。
このような体温調節機構の局在はヒトでも同様であるらしい。視床下部の障害を伴う手術後の体温低下は、よく知られている。このような手術は特に下垂体腫瘍やトルコ鞍近傍の髄膜炎などに適用される。術後の体温低下により死亡した例では、視床下部の全域の障害が報告されている。より軽度な体温低下を起こした場合は、この領域の浮腫や軽い出血によるのかもしれない。
視床下部のそのほかの機能として、立毛が挙げられる。視床下部のある領域を刺激すると発汗が起こることが知られている。視床下部には飲水中枢があり水分調節を行っていることをすでに述べたが、視床下部のある部位は食欲にも関係するらしい。内側部のある核の破壊は過食を引き起こすが、外側部の破壊は拒食を引き起こす。外側の摂食中枢と、内側の満腹中枢が想定されている。視床下部の飲水・摂食中枢については多くの文献がでている。最近の総説、例えばFitzsimons 1972, Grossman 1975など参照。
最近Grossmanは、視床下部外側核にカイニン酸を注入すると拒食が起こることを示した。カイニン酸は神経細胞や樹状突起を選択的に破壊するが、神経線維には影響を与えない。従って、外側核の機械的破壊あるいは電気的破壊も同様に拒食を引き起こすが、この場合当該部位の通過線維の破壊によるということも考えられるが、Grossmanの発見は視床下部の神経細胞が直接拒食に関係することを示している。
食欲と関連するという点で、成長も視床下部に影響下にある。少なくとも成長ホルモンに依存するという点ではそうだ。このような事実は、ヒトにおける視床下部障害と肥満との関係において興味深い。視床下部が消化器系にも影響を与えるということは臨床的にも興味がある。最近動物実験により前視床下部の刺激が消化管の蠕動運動を活発にすることが示された。視床下部後部が刺激されると蠕動運動は抑制され交感神経系に関連する症状が現れる。視床下部の障害は、しばしば胃や腸の出血や潰瘍を引き起こす。視床下部に留置された電極による慢性的な刺激は胃の出血、潰瘍を引き起こす。この場合電極の位置はあまり問題ではない。
視床下部刺激に伴う消化管の変化は、二つの自律神経システムのバランスが崩れたために起こると考えられる。ストレスによる潰瘍は視床下部機能への影響を介しているかもしれない。もう実験的にあるいは臨床的に、視床下部の変化が特にヒトの場合胃潰瘍の進展に関係があるようだ。
性機能も視床下部の影響を受ける。しかし詳細は不明。6章で示したように、視床下部にはWakingとsleeping centersが想定されている。視床下部は情動にも関係。この場合、扁桃体など他の脳の領域との関係が重要である。
Emotional expression and behaviorとemotionとは区別されなければならない。後者は感情であり情動反応は自律系と体性両方の現象を含むわけで、これは感情に伴って必ず現れるとは限らず多くの場合抑制される。
一方、decorticateされた動物でも、emotional reactionは殆ど感情が存在しないような条件でも起こることが示されている。
すべての皮質、基底核、視床を除き視床下部のみを残したような動物でもsham rageという現象が見られる。このような動物は通常なら怒りを表すほどの刺激でなくても、瞳孔の散大、立毛、心拍数の増加、かみつきやうなり声を上げるという反応を見せる。このような反応は、後部視床下部を除くとなくなるのでこの領域に起因すると思われる。通常の情動行動とは異なり、sham rageは行動の原因が取り除かれると直ちに消失する。
人の視床下部障害は多くの場合興奮あるいは抑圧状態を生み出す。圧迫などの物理的刺激が手術時視床下部にかかると、多様な症状が現れる。不安やflight of idea, motor hyoeractivity, talkactiveness, 強い抑圧などが繰り返し起こるとされている。慢性のepidemic encephalitisの際の情動の変化は、特に小児では視床下部の障害に起因すると考えられている。
さらに、発汗や排尿も視床下部の影響とうける。事実この脳の領域の影響外におかれる機能は少ない。高度に統合された多くの機能を視床下部がどのように果たしているかはまだ殆ど理解されていない。末梢の2系統の自律系が視床下部のどの部位の影響下にあるかは区別できそうにない。大まかなところ、視床下部前部には副交感神経系、後部は交感神経系の機能に関係しそうだが、しかし、これまでのところこの視床下部の2つの領域の境は曖昧である。
視床下部には数々の中枢が考えられており、そのいくつかはすでに述べた。神経系における中枢という考え方、すなわち形態学的にはっきりした領域で特定の機能を担う領域といったものは神経系の構成が明らかになるにつれて興味深いものではなくなりつつあり、むしろ容認しがたいとさえ思われる。視床下部について言えば想定された中枢のいくつかは非常に複雑な機能を統合しなければならない。その多くは自律系の機能ばかりではなく、性行動や食行動のように体性神経系や内分泌機能をも含むものである。空間的に限られた領域に存在する一群の神経細胞がそのような高度な統合機能を行うとは考えにくい。中枢という言葉はある特定の機能を適切に果たすために必要な脳の領域の集合と考えた方がいい。そのような領域の障害は機能の阻害に通じる。ある機能が視床下部以外の他脳領域からのeffectを受けることがある。このような場合centersといわれる言葉が使われる。例えば、発汗の神経制御についていえばWang(1964)は、発汗の中枢は毛様体、視床下部、視床、線状体にあり、皮質や小脳も影響を与えると書いている。視床下部と他の脳領域との線維連絡という観点からみると視床下部の制御する機能が他の脳領域の影響を受けるということは想像はできるが、それらの領域のすべてをcentersと考えるのは誤りであろう。自律機能が影響を受けるとき、あるいは機能が体性神経系や内分泌系と統合され複雑かするような場合、まだよく解っていないが何らかの方法で多くの脳領域が緊密な連携をもつということであろう。視床下部により制御される様々な機能の変化が他の脳領域を含む統合された行動の一部をなすことが多い。最近の視床下部研究でこのことが指摘されつつあり興味深い。この統合という考え方は、視床下部が自律機能の統合のうえで特に重要であるという考えと矛盾しない。臨床的に見ると自律機能に対する皮質の影響は興味深い。精神機能と自律機能の関連は明らかであり、そのような例は数多く見られるものの実体は全く理解されていない。
大脳皮質が自律機能に影響するということは理解できるものの、自律機能にのみ関与する皮質領域といったもの存在しないようだ。むしろ、自律機能に関係する皮質領域は体性機能にも関係するという証拠が多い。内臓性のインパルスが皮質で記録されることもある。
例えば内臓神経の刺激はSmI領域では片側性に、SmIIでは両側性に記録できる。上喉頭神経を伝わる迷走神経のインパルスや消化管のインパルス(これは孤束核やVPMでリレーされる)が感覚皮質から記録できる。内臓刺激に対する反応はposterior orbital cortexでもみられる。迷走神経や内臓神経の刺激はこの領域に両側性の反応を引き起こす。この場合刺激の伝達経路は解っていないが、おそらく最終のニューロンは視床の内側核にあり、前頭葉に投射するものではないか?
皮質の様々な部位が自律機能に影響する。例えば分野4と6の刺激は血管運動性を変化させるし、また皮質の様々な部位の刺激が心拍数や血圧に変化を与えることがある。これは実験動物だけでななくヒトでも前頭葉や側頭葉や帯状回の電気刺激により起こることが解っている。7章で示したように、分野19の刺激は瞳孔を収縮させるし、分野8の刺激は散大させる。さらに分野6の刺激は発汗に関係する。胃の分泌や運動も皮質に影響される。実験的に、posterior orbital cortexが心血管機能、呼吸、消化器、体温調節などの機能に特に強い影響を及ぼすことが知られている。神経路はよく分からないが、orbitofrontal cortexから脳幹への線維が含まれるかもしれない。
線維連絡に関する知識は今のところ断片的であるにしても、皮質間のあるいは皮質(特に古・旧皮質等系統発生的な古い脳)と皮質下の扁桃体や視床下部との解剖学的な関係は、これらの構造間の機能的関連を示している。しかし、精神機能といったものはもっぱら皮質のものである。精神活動が自律機能を変化させることはよく知られている(例えば不安や興奮のときのtachycardiaや血圧上昇、おいしいものを思い浮かべた時に唾液分泌がおこること、あるいは恥ずかしい時の赤面など)。このような変化は、皮質を視床下部の解剖学的機能学的関連が密であることを示している(そして他の皮質下の構造は情動と自律反応に関連)。同じような機構が体の働きが精神の混乱に伴うような場合(精神病者のみならず正常人でも)に働いている。いわゆるpsychosomatic diseaseは、このような観点から理解することができる。(特にそれに関連する脳の部位や線維連絡は不明であるが(注38,いくつかの精神機能の体への影響は視床下部-下垂体系の変化による内分泌環境の変化によって現れる。精神的影響は授乳に現れるし、悲しみ等のひどい精神的ストレスは性周期をゆがめるなどはよく知られている。例えば新しい環境での勉強がスタートするときのように、若い女性にとって外的環境の変化は性周期に影響したりする。いわゆる神経性食欲不振症などもこの例である。)
これまで主に大脳皮質(知的機能)の視床下部(情動・自律機能)への影響をみた。一方、その多くは間接的であるが視床下部から皮質への連絡もある現象を説明してくれる。情緒的状態が皮質の知的機能に影響することはよく知られている。これは視床下部をも含むであろう。内分泌環境も辺縁系も重要。
すでに述べたように自律神経系の末梢部分では交感と副交感の線維(それぞれ脳・仙髄または胸腰部からくる)は通常まざりあって走行する。体腔の大きな自律神経叢は両方の線維を含み、神経節細胞もここに存在する。この状態は解剖学的、生理学的研究を困難にするが外科領域では重要である。ここでは、末梢の自律線維の経路については体系的に述べることはしない。特に局所的形態よりも機能について概要を説明することにする。迷走神経については7章で述べたのでここでは、交感神経系と仙骨部の副交感神経線維を記載することにしたい。
これらは交感神経幹から灰白交通枝を通って末梢神経に入った節後線維であり、立毛筋、汗腺、末梢血管などへ分布する。これらの線維を刺激すると立毛、発汗、血管収縮がおこる。(p757)様々な臓器あるいは体の部位に行く交感神経線維はTH1-L2の限局した領域から供給されるということは早くから実験動物においてもヒトにおいても明らかにされていた。腹根の電気刺激は立毛や発汗、血管収縮を起こすがこれは同側性でTh2-Th4の刺激は頭頚部、Th3-Th6は上肢、Th10-Th12は下肢を支配する。交感神経幹1つの神経節には2つ以上の髄節に由来する節前ニューロンが終わるので、1つの灰白交通枝は2つ以上の髄節からの刺激を伝えることになる。したがって単一の腹根の刺激の効果は単一の皮膚節に反映するわけではなくもっと広く現れる。しかしながらある程度髄節に関連した影響を示す。
例えばGuttmann (1940)は、いくつかの頚神経節を除去した患者で熱にさらされても発汗が起こらない部位を検討し、それ以前の結論を支持、発展させた。上頚神経節を除去するとC2とC3の皮膚節にそれぞれ一致する顔面と上頚部の発汗が起きなくなる。中頚神経節では、下部の頚部と肩 (C4とC5)、下頚神経節ではほぼ全部の上肢に発汗が起きなくなる。例外は内側部で、ここは上部胸神経からくる。(このように発汗が部分的に抑えられると、近接部位では代償的に発汗が増える。)Richter and Woodruff (1945)は交感神経支配を欠く体表では電気抵抗が増すことを利用した。彼らは外科的に腰部あるいは仙骨部の交感神経節を除いた患者の体表の電気抵抗の上昇を調べた。交感神経系の皮膚節はこのようにして概略が決められ、これはだいたい近くの皮膚節と一致下。頭部、体幹でも同様の結果であった。この方法は、その後何人かの研究者に使われた。
末梢では交感神経系の線維は体性線維と伴行する。従って、末梢神経が灰白交通枝を取り込んだ後の部位で刺激されると立毛、発汗、血管収縮は体性神経系の分布に一致した領域で起こることになる。
交感神経刺激は立毛筋を収縮させ立毛を起こす。その結果皮膚はよく知られた鳥肌の状態になる。
立毛に関係する交感神経線維はヒトでは重要ではないが、診断の際には何らかの情報を与えるかもしれない(動物では立毛は体温調節に重要)。立毛の起こりやすさはヒトによって異なる。立毛を促す適当な刺激は寒さであるが、deep pressure、不快な鋭い音、心理的な刺激も立毛を起こす。このような場合、皮質-視床下部線維の関与が考えられる。しかし、局所的な皮膚刺激による場合は反射である。反射の中枢は脊髄にある。従って、脊髄の損傷は立毛反射を消失させる (もしTh1−L2の間に起これば)。立毛反射は肩と腰あたりに最もよく現れる。反射による立毛は、最初に起こった部位から吻側、尾側へ広がるが、必ず動側に限られる。もし脊髄に損傷があるとこの縦方向の拡散は起こらない。これはつまり、脊髄中を反射弓の刺激が上行あるいは下降できないためである。しかし、交感神経節は複数の髄節からの線維を受けるという解剖学的な事実からしても、感覚の喪失と立毛反射の喪失の位置は一致しないということを忘れてはならない。例えば,Th9で脊髄が切断されたとしても、肩で発生した立毛反応はTH10に相当する皮膚節までは波及する。またこの場合、腰髄レベルに発生した立毛は,Th8-7の皮膚節まで及ぶ。
交通枝や交感神経幹の切断は立毛反射の変化をもたらす。星神経節の切除により術側の頭頚部の立毛反射は消失する。末梢神経が切断されるとその支配領域の立毛反射は起きない。例えば、橈骨神経の切断は上腕と前腕の背側の立毛反射を消失させる。(?)立毛反射を調べるときは室温の影響を配慮するべきである。そして結果は厳密な解析を必要とする。混乱を招きやすい局所的立毛というものがある。この反射は麻酔された領域でも起こる。
汗腺へ分布する線維は既に述べたように立毛筋への線維と伴行する。しかし、立毛線維と異なり汗腺への線維はコリン作動性である。末梢神経の損傷は線維の興奮を引き起こし、その支配領域の発汗を促す。しかしさらにひどい損傷は神経伝達をブロックし発汗も消失する。これは橈側3指および第4指の橈側半に分布する正中神経の損傷時に最も顕著に見られる。麻痺した領域では皮膚の乾燥が起こる。脊髄の損傷では発汗反射の変化は立毛反射の変化と同様である。しかしながら脊髄のsudomoter reflexはまったく起こらない。発汗は体温調節に特に重要であり、これは主に視床下部によって調節されているようだ。体温調節のための発汗は、体温上昇に伴って起こる。そして、これは視床下部に発するので切断部位より以下の髄節には及ばない。加工性線維が切断されるわけだから。脊髄神経根や交感神経節の損傷はその支配領域の乾燥をもたらす。
ここで言う汗腺とは全身に分布するコイル状の管状汗腺であるエクリン腺のことである。存在部位が限られている、特に腋窩に多いアポクリン汗腺は構造的にも機能的にもエクリン腺とは異なる。アポクリン腺はアドレナリンによって支配され、従ってsympathiocomimetic drugsに反応する。アポクリン腺は体温調節のための発汗はせず、よく知られているように精神的ストレスに反応して分泌を行う。アポクリン腺はアドレナリンによる液性の影響を受けているようだ。交感神経切除はヒトにおいてアポクリン腺の分泌を消失させないといわれている。
発汗よりもさらに重要なのは血管運動性の線維である。交感神経に属する血管運動性線維は殆どの場合収縮性である。末梢では血管運動性線維は立毛や発汗の線維とともに走る。従って、これらの線維と同様分節的分布を示す。大脳の血管も交感神経支配を受けているということは間違いないようだ。交感線維は動脈、小動脈、小血管に分布している。交感神経幹から出る直接の線維はその近位では大血管にのみ伴行するということはある意味では重要である(例えば、上腕動脈や大腿動脈の初めの部分)。動脈の末梢部分には微細な線維が分布している。大動脈を取り囲むような神経叢を離れると、交感神経線維は動脈壁にも見られるようになる。害幕ではこれらの線維は部分的にミエリンを持つが、筋層に入ると微細な無髄線維となる。動脈壁の線維のあるもには感覚性・求心性である。他の内臓性求心性線維と同様、それらの線維の細胞体は脊髄神経節にある。これらのうちあるものは、痛覚を伝える。動脈の外膜では感覚の受容体が見られる。例えば、Vater-Pacinian corpsclesなどである。交感神経の節後線維を切断すると、これらのあるものは外膜の一部の細線維と同様退縮する。最後に、動脈壁に記載された細胞のうちのあるものは、末梢の自律神経系の細胞であると考えられる。これらの細胞は、交感神経線維と平滑筋の間に位置している。これらは局所的な血管運動性線維であると考えられるが生理的な重要性に関しては疑問である。
毛細血管は非常に細い神経線維を伴っているが、その線維の性格は明らかではない。交感神経系もアドレナリンも、毛細血管に対しては明確な作用を示さない。アセチルコリンもそうである。毛細血管は中小の血管とは異なる機構で血管を変えるようだ。これは例えば発熱時にみられる。毛細血管の収縮により皮膚は蒼くなるが、同時に小動脈の拡張により熱がでる。様々な方法で毛細血管の径の変化が研究された。その結果によると、以前の研究によって考えられた、毛細血管の収縮は血管壁付近に存在するRouget-Mayer cellsにより収縮するということはどうも受け入れがたいようだ。
動静脈吻合は、動脈と静脈を直接交通させるもので多くの場所でみられる。これに関する研究が進むにつれて、動静脈吻合は多くの器官でみられるということが解った。それらは規模も複雑さも違うが、一般的にいって耳介や手足のような体の末端でよく発達している。通常血管はここではコイル状で、動脈の終末には多くの収縮性の細胞がみられると同時に、交感神経線維もみられる。動静脈吻合は明らかに毛細血管網の血流を調節している。動静脈吻合を開くと皮膚への血流が増す。例えば、寒冷時の耳や指先のようにである。末梢循環やこれに影響を与える因子(神経性あるいは液性の)は大きく複雑な研究領域である。多くの反射が含まれる。末梢血管の収縮・拡張は下位脳幹の網様体、視床下部、皮質の一部などの刺激により引き起こすことができるが、結局のところこのような中枢性の制御は、末梢の自律神経系を介して働くのである。
すでに述べたように、血管に対する交感神経系の主な作用は収縮性である。この作用を仲介する伝達物質がノルアドレナリンであるということは間違いないようだ。血管拡張性神経線維の存在は議論の的であった。(注43血管径の変化というものは、収縮力の変化によって生まれるものだということを忘れてはならない。積極的に血管を弛緩させる(拡張させる)構造はない。それ故、神経の制御による血管の拡張というものは、血管の静水圧に対抗する血管収縮力の緊張度の変化によってのみ生み出されるわけだ。)このような線維は鼓索神経や外性器に分布する副交感神経中にあるということは一般的に認められているようだ。この場合伝達物質はアセチルコリンであろう。神経刺激により血管拡張が起こるということから、以前は解剖学的知見とは矛盾するが、末梢神経中に副交感神経が入っていると考えられた。この矛盾は今では解決されている。すなわちすでに述べたように、解剖学的に交感神経神経系に属する神経線維のあるものはコリン作動性である。汗腺ばかりでなく血管へ行く線維もコリン作動性なのである。これは骨格筋において特によく知られている。このような線維が、皮膚や心、小腸などにも分布するかどうかは、よく分からない。
交感神経の束を刺激したときは血管収縮性線維の効果が優位に現れ、血管拡張性線維の作用はマスクされてしまう。それでも、中枢神経系のある領域への刺激が血管拡張を明らかに引き起こすということは、交感神経系の持つ血管収縮性と拡張性の作用は正常状態ではそれぞれ独立して働いていることを示している。交感神経系の末梢部分の疾病では,血管拡張が優位に現れる症状である。
上部頚神経の腹根を刺激すると同側の頭頚部の血管収縮を引き起こすことはすでに述べた。皮膚は冷たくなり、当然顔色が蒼くなる。汗の分泌と立毛が同時に起きるかも知れないがこれらは正常時でも、病気のときもそれぞれ独立して起こるのである。
星状神経節の除去は頭頚部の血管拡張を引き起こす。その結果皮膚は赤くなる。これは当該領域に血管収縮性の刺激が行かなくなった結果である。つまりそのような線維は、星状神経節を通過するのである。一部の線維は動脈に沿って上行するが、他のものはこれから離れ、脳神経に入る。
交感神経除去の影響が低下するために、例えば星状神経節の切除によって起きる血管拡張は1,2週のうちに弱くなる。第2、第3頚髄節由来の白交通枝を切断し、さらに第2、第3神経節を分離させると、節後線維は無傷で残り、sensitizationは弱く効果は長続きする。従って外科医は節後線維を切断する星状神経節除去よりも、節前線維の除去を好む。
末梢神経や、腕神経叢、腰・仙骨神経叢を除去(切断)した場合、血管収縮機能の麻痺がみられる、しかし一般的にいって体温が変化したり、皮膚が赤くなる等の影響は長続きはしない。末梢神経の刺激的損傷の後には明らかに血管収縮か起こる。中間外側核の限局した領域の損傷は、一般的にいって明確な症状を起こさない。これは各々の交感神経幹の神経節が複数の髄節から線維を受けるからだ。血管運動反射は血圧調節、ひいては各臓器への血液の分配という点で最も重要である、この反射には脊髄反射も含まれる。他の血管運動反射は縦方向の反射弓を持つものもある。これらの反射弓は脊髄のそんしょうの時変化を見せる。損傷後の再構成時には血管運動反射は通常損傷部位よりも下位で増強する。脳幹の損傷においても同様である。L2以下の脊髄の損傷は、血管運動星の変化を伴わない。これはL2以下には中間外側核の細胞がいないからだ。
ヒスタミンを皮内に注射すると血管拡張によりその付近に発赤が起こる。ついで局所的浮腫が起こり発赤は紫に変わる。この範囲は時間と共に広がる。同様の反応が刺激物を皮内に投与したときに起こる。例えば蒸留水や弱酸などである。このような場合刺激物は周囲の構造を破壊する。その結果ヒスタミンが放出されることになる。驚くべきことに、このようなヒスタミンの作用は末梢神経を切除した領域では起こらない。皮膚が紫になるだけである。これはヒスタミンの反応に神経要素が関係することを示している。この場合重要なのは皮神経である。皮膚の知覚神経が長時間刺激されると、その神経の支配領域に強い血管拡張が起こる。背根を刺激するとそれに対応する皮膚節に血管拡張が起こる。
血管の拡張は後根から発した知覚線維の中を末梢へ走行する線維によって起こるように見える。血管拡張刺激は、遠心性の後根線維、きわめて細い無髄神経によって伝えられると考えられる。この場合血管収縮を伝える線維は他のものと逆向きの情報を流すのでantidromic impulseである。
そのようなimpulseが後根の人工的刺激によって発せられ、これがerption in herpes zosterの形成をもたらすとしてもこのようなことが正常状態でも起こるかどうかは解らない。局所的な刺激物、特に発痛物質による血管拡張はいわゆる軸索反射(axon reflex)によるようだ。細い知覚線維は末梢で分枝すると考えられている。皮膚の刺激のインパルスは中枢方向に伝えられ痛みとして認識されるばかりではなく、側副枝を通って末梢にも伝えられる。その末端ではヒスタミンや他の血管拡張物質が放出され毛細血管を拡張させる。刺激が強いと血管の透過性が亢進し浮腫を起こす。この考え方は後根線維を脊髄神経節の遠位で切断したときに何故このような血管拡張作用が直ちに消えず、神経線維が破壊される数日後にならないと消失しないかを説明できる。神経線維が破壊されると発赤は消える。炎症の三種類の反応は、中枢神経系の影響下にあるのである。
これまでに自律神経系の昨日について一般的な記載をした。以下は内臓の自律神経支配についてである。2-30年前に比べると、内臓の自律神経支配に冠する諸問題は複雑になってきた。自律神経系による内臓支配の大陽は765ページの表にまとめてある。より詳細な情報はBonica(1968)に記載。これはヒトにおいて、麻酔による自律神経ブロックからの情報に基づいている。例外があるものの、交感神経系と副交感神経系は拮抗的であると考えて良い。
眼球の自律神経支配については,7章ですでに述べた。副交感線維は瞳孔を収縮させ、毛様体筋を収縮させる。同様の効果はピロカルピンやエゼリンなどの薬剤に依っても得ることができる。動眼神経の麻痺は外眼筋の麻痺と共に、瞳孔散大、遠近調節機能の麻痺をもたらす。アトロピンは瞳孔散大させる。眼球へ行く交感神経も瞳孔を散大させる。これはおそらく虹彩の血管収縮させることに依ると思われる。交感神経の眼球への侵入を遮断すると、縮瞳が起こる。これはすなわち、上頚神経節からの線維の切断や、第1、第2胸髄から、下・中頚神経節を通る節前線維の損傷の結果である。上位胸髄の損傷は通常同側の縮瞳を引き起こす。これは正確には第1、第2胸髄の中間外側核の損傷の結果であり従ってこの部位は、Centrum ciliospinaleと呼ばれる。しかしもしこの部位に至る神経路が障害を受けるなら、同様の症状は頚髄や延髄の損傷においても起こる。このような場合の全てにおいて、瞼板の筋も麻痺するので、縮瞳ばかりでなく眼瞼下垂やenoptalmos(眼球が対側に比べて眼窩の深部に位置する)が起きる。後者は通常眼窩下部の筋の麻痺に依って起こるとされているが、この部位の筋は薄いので、そうではないかもしれない。眼瞼下垂が原因か?縮瞳、眼瞼下、enoptalmosのみられるものを,Hovner's症候群という。
脚注 交感神経の節前線維の損傷か、節後線維の損傷かを見分けるために臨床医は、アドレナリンを滴下して瞳孔の反応を見る。節後線維の損傷すなわち上頚神経節の末梢側に損傷がある場合は、アドレナリンに依って瞳孔は著しく拡大する。これに対し上頚神経節より中枢側に損傷が加えられた場合(すなわち節前線維の損傷)は瞳孔は正常な反応、つまり少ししか拡散しない。この違いは、節後線維の損傷による感受性増加の例である。
Hovner's症候群では同側の発汗障害も起こる。Reader's paratrigeminal syndromeも時折みられる。この場合、縮瞳と眼瞼下垂はあるものの発汗障 害はない。すなわち眼球への交感神経は損傷を受けるものの顔面へのものは正常である。この病気は通常眼上部の頭痛を伴う。Readerはこのような症状を頭部外傷や腫瘍の患者に発見し、内頸動脈周囲の交感神経線維の損傷であると考えた。後の研究からこの病気は偏頭痛と関連すると思われる。
涙腺には分泌性の副交感神経線維が行く。例えば頬骨の骨折のようにこの線維が損傷を受けると、反射的な涙の分泌が起こらなくなる。この反射は結膜や鼻粘膜の刺激によって容易に起こる。このときの弓新繊維は三叉神経を通る。
消化器系の器官は全体的に分泌性・運動性の線維を副交感神経系から受け取る。抑制作用は交感神経系から(もっともこれは多少の修正が必要かもしれないが)受ける。唾液腺への副交感線維についてはすでに述べた。鼓索神経の刺激は顎下腺と舌下腺の分泌を促す。交感神経系は唾液分泌についてはそれほど重要ではない。副交感線維の損傷はこれらの唾液腺の分泌を止める。すなわち嗅覚、味覚、刺激や美味しいものを想像することによって通常起こる唾液分泌が起こらなくなる。後者の分泌は皮質に始まる。
胃や小腸への副交感線維は分泌性であり運動性である。迷走神経の刺激は蠕動運動を増し、胃や小腸での腺分泌を促進し括約筋を弛緩させる。すでに述べたように直腸と下部結腸は千頭委から副交感線維を受ける。消化管に対する交感神経の作用は一般的にいって抑制的である。交感神経刺激は蠕動を止め、分泌を抑制し、括約筋の緊張を高める。胃液の分泌と胃の運動は物理的、味覚、嗅覚刺激によって起こるが、これは迷走神経に仲介される。しかし両側の迷走神経と内臓神経を切除した後もかなりの分泌と運動が残り時が経つと正常に戻る。このような残存する分泌性・運動性昨日は消化感激の神経細胞や神経叢(Meisner or Auerbach)に依ると考えられる。膵外分泌部は迷走神経から分泌性線維を受ける、交感神経性あるかもしれない。伝瞼的には交感神経線維は膵島にみられる。β細胞はアドレナリン作動性、コリン作動性線維を共に受けるようだ。しかしインスリン分泌における働きは不明。肝には交感線維のみが行く。しかし胆嚢と胆管には迷走神経がmotor線維を運ぶ。迷走神経刺激は胆嚢を収縮させ、Oddiの括約筋を弛緩させる。消化器系では、局所的な自律性が良く発達しているので消化器の症状は自律神経系の疾病の時はっきりしない。
交感神経に依る心の刺激は頻脈を起こすし、副交感神経刺激は徐脈を起こす。さらにそのような刺激は心筋や冠血管にも影響を与える。交感神経や副交感神経の節後線維の心への分布はまだ解明されたわけではない。心室は交感神経線維のみを受けるが、心耳や房室束は交感・副交感の両方の線維を受ける。房室結節は主に右の迷走神経支配、迷走神経刺激は心拍数を低下させる。冠動脈に対する交感神経の白湯尾は不明確な点があった。他の血管系への作用とは異なりこの交感神経の作用は弛緩であることは意見が一致していた。これは交感神経刺激の時の心の要求性と一致している。しかし、交感神経刺激の弛緩作用は心筋の活動の変化の結果ではないかという議論があった。心臓への交感神経線維に供給は上頚神経節からばかりではなく上位4−5胸神経節にも由来することは重要である。心からの求心性線維の殆どは交感神経系を辿る。迷走神経に含まれる心の求心線維は大動脈や頚動脈洞反射に関わるものである。(頚動脈洞反射はの殆どは、舌咽神経に依る)
肺や気管には自律神経線維が豊富である。微細な線維は動脈に沿って呼吸細気管支まで追うことができる。そこで神経線維は平滑筋に終わる。第2-第4胸神経に由来する交感神経の刺激は気管支を弛緩させる。これに対し迷走神経刺激は気管支を収縮させ気管支腺の分泌を促進する。気管支喘息におけるアドレナリンとアトロピンの作用は気管支に対する二種の自律線維の作用を証明している。呼吸器からの求心線維は多くは迷走神経に含まれ延髄の呼吸中枢の反射に影響を与える。肺の血管への神経支配はよく分かっていない。しかし。他の臓器におけるほどはっきりはしないが交感神経刺激は血管収縮性であるようだ。
腎は血管系に沿って入ってくる交感神経の支配を受ける。内臓神経の切断は、数週間にわたり尿量を増すといわれている。しかしこれは腎への血流増加の結果かもしれない。腎に迷走神経線維が入るかどうかはよく分からない。尿管には交感・副交感共に線維を送る。しかし尿管の蠕動運動はこれらの線維を切断しても変わらない。
膀胱に対する自律神経支配は重要である。副交感神経線維は第2-第4仙髄節に由来し陰部神経叢の内臓枝を通る。これは下腹神経叢と内臓神経叢からの交感神経成分と合流する。ヒトでは截然線維はL1−L2から主に来るがTH11-12のものもあるかもしれない。このうちあるものは膀胱へ分布する節後繊維が多く集まっていると思われる上位4腰神経節まで交感神経幹を下降する。他のものは下腹神経叢中の神経節へ向かうと思われるが、この辺りは不明確。副交感神経の節後ニューロンは奬膜かあるいは膀胱の筋束の間に存在する。膀胱の求心線維は遠心性線維の経路を逆こうする。膀胱壁には受容体がある。膀胱の膨張を伝える伸展受容器からの線維は臨床的・実験的に骨盤神経を通るとされている。交感神経の求心性線維は痛みに関係すると考えられている。横紋筋である外尿道括約筋はS3-S4からの体性遠心性線維を受ける。これは陰部神経を通る。最近のHRPヲ用いた研究から、ネコでは外尿道括約筋や会陰の横紋筋(外肛門括約筋、肛門挙筋など)への運動ニューロンはS1-S2からでることが示されている。膀胱の神経支配の要点を図11-15に示す。
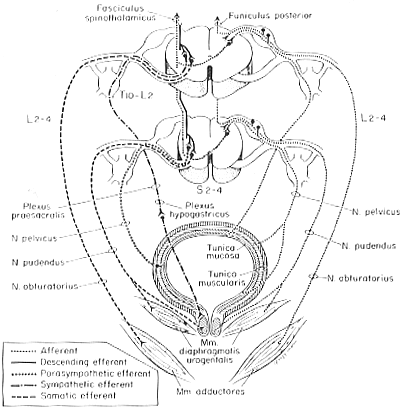
FIG.11-15 A diagram of the main features of the innevation of the urinary bladder. Efferent nerve fibers are shown on the left, afferents on the right. See text. From bors and Porter (1970)
排尿の生理は複雑でしかもこれに関わる神経機構の解明も不十分である。排尿の主要な刺激は膀胱の拡張である。基本的には脊髄反射である(S2-S4への膀胱の知覚線維aこの髄節にある反射中枢a中間外側核から膀胱壁へ伸びる節前線維a筋へ分布する節後線維)。しかしながらこの基本的な反射弓は、より高次の支配を受ける。正常状態では脊髄の排尿中枢はおそらく橋にあるより高次の中枢の支配下にあるとする証拠がある。膀胱の求心性インパルスは大脳皮質へも届く、排尿作用に関するいくつかのデータについて考えてみよう。内尿道括約筋は膀胱の筋層からは分離されていると考えられていた。後者は一括してdetrusorと呼ばれる。排尿の間副交感神経刺激による排尿筋の収縮は、内尿道括約筋に対する交感神経系の抑制作用と協調していると考えられていた。しかし事はそれほど図式的ではない。最近の研究では内尿道括約筋とは膀胱の出口付近、特にはい背側に位置する重層の排尿筋の一部であるらしい。排尿の時内尿道行の開口は単に排尿筋の収縮のみによって起こり、内尿道括約筋に対する抑制は必要ではない。Urethro-cystographyを用いたヒトにおける研究結果もこれを支持している。
アドレナリン作動性神経線維や終末を証明する蛍光法を用いて、Hmberger and Norberg (1965)は交感神経線維は膀胱三角(尿管の開口部と内尿道口を含む)に限られることを示した。膀胱三角は膀胱の他の部分は内胚葉性であるのに中胚葉由来であることは興味深い。
排尿に先立って膀胱には副交感神経性に刺激がもたらされるということに異論はないが、交感神経の作用については議論が多い。膀胱の機能を考えるとき忘れてならないのは、膀胱には二つの機能があるということである。すなわち尿管から流れ込む尿を受け入れることと、内容を排出することである。通常、膀胱がある程度まで尿を貯めたときに排尿が起こるという点で二つの機能は関連している。排尿の刺激となるのは尿量ではなく筋の緊張度である。これがあるレベルに達すると伸展受容器からの求心性刺激は中枢に向かい(主に骨盤神経を経由して)仙髄に至る。そして、副交感性の細胞を刺激することにより排尿筋を収縮させる。外尿道括約筋の開口はその後に起こる。膀胱壁は一定の緊張を保っている。そしてゆっくりした律動的な収縮作用を示す。膀胱壁の緊張は膀胱の固有の時性だとするヒトもいるが、これは自律神経系の影響に基づくものだとする考えもある。尿がたまる間は、内臓神経節や膀胱に筋には交感神経による抑制的な影響があるためこの時期には膀胱の排尿筋に対する副交感神経の作用はないようだ。このことは筋緊張を高める事なしに多量の尿を蓄積する事を可能にしている。排尿時には交感神経の作用は減じて、反射弓が働く。全ての研究者が排尿筋に対する基本的な刺激は副交感性だと考えている。膀胱三角の収縮は射精の時も起こる。これは精液が膀胱に逆流することを防ぐ。これは交感神経支配らしい。
外尿道括約筋は排尿を意識的に止める筋である。排尿筋が収縮しているときでも、非常に効果的に収縮し尿道口を閉じる。排尿時の尿道口の開口は反射による。Petersonらによるヒト外尿道括約筋の筋電図に依る研究では溶くにurethro-cystographyとあわせた方法により興味ある結果が報告されている。
上記のように、排尿は基本的には脊髄反射によって起こるとしても、精髄損傷の患者で経験するように排尿はより高度の支配を受けている。他の殆どの機能がそうであるように、膀胱の機能もいわゆる排尿中枢といわれる脳の一部の支配下にある。電気刺激により排尿の促進あるいは抑制が以下の領域にみられる。即ちsensorimotor area I and II, orbital gyrus、梨状皮質、扁桃核、視床下部、上丘、網様体等である。促進と抑制は別々の部位で現れる。抑制はさらに、赤核、黒質、視床下核、視床の一部の核、被殻等の刺激によっても起こる。これらの核の刺激による効果が、どの程度下行性線維の刺激によるかは不明のようだ。ヒトでは、排尿や排便はsuperomedial part of the frontal lobeの障害により影響を受けるようだ。(p770, l3)
脊髄損傷の影響による膀胱機能障害の臨床的重要性のため、排尿に関する下降路の研究は興味を集めた。脊髄の障害を受けた多くの患者からNathan and Smith (1958)は中心管を通る赤道面における両側性の脊髄損傷は排尿に関して脊髄の切断と同じ効果を持つことを示した。この経路は主に意識的な排尿の制御に関係するももので、皮質脊髄路に含まれるらしい。もしそうならば、これは動物で研究されている下行性のvesicopressor線維ではない。
膀胱からの求心線維の中枢神経系内の経路は良くわかっていない。Nathan and Smith (1951)によれば、膀胱の拡張を伝え、尿意をもたらす求心性線維は側索の腹側表層を通る。膀胱や尿道の痛覚を伝える線維も同じところを通る。このような結論は、多くの脊髄切断患者の診断に基づいている。膀胱機能の中枢支配は何も解決を見ていない。しかし、これはヒトにおいて特に重要である。最も考えやすいのは、直接的な皮質脊髄路による支配であるが、これによる意識的な制御と視床下部の影響との緊密な協力が膀胱死のうには重要であろう。
このように基本的な排尿反射は単純な脊髄反射ではないという事は理論的にも臨床的にも興味深い。膀胱からの求心性線維の電気刺激による仙髄の節前線維の発火は遅い(80-120msec in the intact cat)。これは急性の脊髄動物では起きない、つまり橋の青斑辺りの中枢が関与していると考えられている。慢性的な脊髄動物では自動的な排尿が起きるが、これは仙髄レベルの短時間ごとに起きる(short-latency)反射に依るらしい。
膀胱機能に関係する様々な領域の損傷は排尿障害を引き起こす。ヒトでは脊髄の損傷が膀胱機能障害の主な原因である。障害の部位により症状が異なる。仙髄の障害では、もしそれが両側の側索にわたれば膀胱の随意制御が失われる。線維の伝導が完全に失われれば、膀胱の制御は失われ、ある程度尿がたまるとすぐに排泄されてしまう。このとき正常よりも少量に尿の蓄積で反射が起こってしまうのが普通である。これは通常、上位の抑制作用の減弱で説明される。(既に述べたように脊髄切断直後は膀胱機能は完全に麻痺する)部分的な損傷では頻尿になることが多い。これは上位の制御が不完全になるからである。というのは患者はある程度排尿を抑えることができるからである。これは、diseminated sclerosisでよく見られる。膀胱の求心性・遠心性線維の損傷については仙髄の損傷との関連においてあとで述べることにする。
生殖器への樹立線維の分布はよく分かっていない。生殖器官(性腺)は血管由来の交感線維を受ける(internal spermatic or 卵巣動脈)。この線維は、下部Thから来る血管運動性線維である。精嚢や前立腺、精管に分布する交感神経は運動性あるいは血管収縮性である。下腹神経叢の刺激は射精をひき起こす。前立腺には副交感神経線維も分布するが、副交感神経系主な作用は勃起器官の血管拡張である。勃起は主に副交感神経のインパルスによって引き起こされる。そして、勃起中枢は仙髄に想定された。一方射精は下部胸髄や上部腰髄からの交感神経線維によって起こる。従って射精中枢は脊髄のこの辺りの髄節にある。
子宮や卵管に行く運動性線維は交感神経のようだ。線維は主に筋層へ分布。子宮に行く腹交感線維があるかどうかは疑問だ。交感神経の子宮への作用は妊娠中であるか否かによって異なるが、いづれにしても大して重要ではなさそう。子宮はかなりの自律性を持っているようだ。従って、実験的に完全に神経を除去された子宮も実験動物では分娩に際して正常に働く。ヒトにおいても完全に脊髄が切断された患者でも子供を正常に出産することが出来ることが知られている。
内分泌器官に対する自律神経線維の重要性はまだ良くわかっていない。内分泌器官の中で最も明らかに自律神経の影響下にあるものは副腎髄質である。これは小内蔵神経とおそらくTh12とL1からの多くの交感神経線維を受けている。このような線維は多くは節前線維である。そしてその刺激は大量のアドレナリンを放出させる。交感神経の興奮は突然の大量なアドレナリンの放出を引き起こし、交感神経亢進症状を呈するようになるので、このことは機能的にも臨床的にも興味深い。副腎髄質への交感神経支配は特に危機的な状況で有用である急激なしかも広汎な交感神経活性状態をもたらす。
さまざまな器官の血流に対する自立系の影響について述べてきたが、以下に残された脳の血管の神経支配と自律神経系の脳血流に関する役割について記載する。脳血管系に関する自律神経支配についてはまだ十分ではない。脳の細動脈に分布する神経線維の存在は古くから形態学的に指摘されていたが、その重要性については疑問であった。このような線維は上頚神経節に節後線維の細胞体を持ち頚動脈や椎骨動脈周囲の神経叢を経由する線維である。これはFalck and Hillarpの蛍光法の導入により脳内の動脈周囲の神経叢の線維がノルアドレナリン作動性であり、上頚神経節の摘出により傾向が消失することが示されたことにより確実なものとなった。脳内の血管に分布する副交感線維は中間神経に由来すると記載されている。組織化学的研究により、ノルアドレナリン線維に混ざって、コリン作動性線維が大脳の血管に分布することがわかっている。
電子顕微鏡観察によると、脳の血管壁に神経終末が認められる。しかし、ヒトや、ネコそのほかの動物でも、神経終末は外膜に限られており筋層にはない。つまり神経終末は筋層の最外層の細胞と接しているわけだ。この神経筋接合はen passage typeで、同様の構造は他の多くの器官の動脈に見られる。終末は空胞状あるいは大小コアを持つ有芯小胞を含んでいる。このような小胞の存在はそれぞれ、コリン作動性あるいはアドレナリン作動性神経終末の存在を示すものと思われる。
ヒトにおいても実験動物においても、一般的に解剖学的研究と生理学的研究による結果は良く一致している。交感神経は脳の血管を収縮させるし、中間神経によってもたらされる副交感刺激は血管拡張を引き起こす。しかし、交感神経や副交感神経による脳血管の変化がどのような生理的役割を果たしているかは不明である。
局所的なあるいは動脈内へのノルアドレナリンの投与は脳血管の収縮を起こす。D'Alecy and Feiegl(1072)は星状神経節の電気刺激が脳血管の収縮を起こすことを犬で示した。ヒトでは正常状態では血管収縮性の線維はあまり働いていないようだ。顔面神経(中間神経)の刺激によって、脳血管の拡張が起こることを何人かが認めている。
遠心性線維に加えて、脳の血管系には求心性線維もみられる。局所麻酔科の患者における血管の電気刺激において明らかなようにその一部は痛覚を伝える。これらはおおむね三叉神経の枝のようだ。硬膜静脈洞、テント、鎌に分布する三叉神経が痛みを伝えるということは臨床的に興味深い。
二酸化炭素濃度ばかりではなく多くの液性因子が脳血流の調節に関与しているということは以前から知られていた。二酸化炭素分圧の上昇は脳の血管拡張を惹き起こすが、低下は逆に血管を収縮させる。脳の血流はかなりの自律性を持っており、体循環の大きな血圧の変化に対応して脳血流は一定に保つことが出来る。神経要素の働きは弱いようだ。脳循環の神経性の調節機構はより基本的な調節機構の上で働いており、局所的な組織の要求性に応じて短時間に微細な脳循環の調節を行っているらしい。12章で述べるように、大脳皮質の特定の領域の血流はその部位の活動状態と関係する。
内臓知覚・関連痛
臨床的に見て求心性内臓線維は遠心性線維に劣らず重要であるが、これに関する知識はまだ全く不完全である。内蔵性求心性線維は、内蔵反射に関してとりわけ重要である。そのいくつかの例をすでに示した。しかし、内臓性求心性線維の一部は神経系のより高次のシステムに伝えられることは明らかであり、この場合意識に昇ることになる。正常状態ではこれらの刺激はあまり重要ではなく、明確に意識されることはない。つまり、このようなときの内臓感覚は空腹感とか膀胱や腸管の膨満感といったような漠然としたものである。しかし、病的な状態では内臓知覚はより鮮明に意識され、臨床的に重要である。
内臓知覚に関する知識は全く不完全である。これに関する実験的研究についてはこの章ですでに述べた。この問題に関するmost present-day informationは、臨床的観察から得られた。内臓自体は、さわったり、切ったりあるいは温度に感受性がないと考えられていた。従って、内臓の手術は局所麻酔で行われた。このような手術では、壁側腹膜、胸膜、心膜を触診したときや、腸管膜を広げられたときに、患者は痛みや不快感を訴える。よく知られているように、多くの内臓の病気は痛みを伴わない(例えば、edocarditis、結核などの肺疾患、腎癌などの時)。一方、内臓の病気が激しい痛みを伴うことがあり、これは臓器が感覚を持たないどころか、多くの知覚線維の供給を受けていることを示している。内臓痛には共通の特徴があり、これによって内臓痛は体表の痛みとある程度区別される。内臓痛は痛みの範囲が不明確であり、皮膚に投射する傾向がある。従って、患者はしばしば痛みは体表からくるものと考える。これが関連痛である。
内臓痛をもたらす状態には他の考え方もあるかもしれない。最も一般的に言うと、痛みは中空性内臓を膨らませたときに起こる。これはおそらく主に器官の膨張が器官の壁にある平滑筋を強制的に収縮させ、いはゆる痙攣を起こさせるからである。例えば、尿管や胆管の結石などである。このとき痛みは発作的に起こる。内臓痛のもう一つの原因は、肝臓や脾臓などの内臓の皮膜を広げることによる。心では、突然の酸欠がひどい痛みをもたらす。これは他の臓器でも同じかもしれない。炎症を起こした内臓の痛みは、筋性の壁の収縮によるか、腹膜への刺激によるようだ。
すでに述べたように、内臓性知覚線維は体性線維のように細胞体を脊髄神経節に持ち、後根を通って脊髄に入る。これには細い線維も太い線維もある。内臓性求心性線維の経路は、内臓痛の外科的治療のために特に重要である。内臓痛を伝える線維の殆どは、交感神経線維と共に走る。従って、内臓神経や交通枝を切断すると胃や腸管など上腹部の内臓の痛みをおさえることができる。同様に、その臓器に交感神経線維を与える脊髄の髄節の後根を切断するのも有効であろう。例えば、胆管の痛みは内臓神経の切断と同様、4-10胸髄の後根の切断によっても絶つことができる。このようなことからも解るように、少なくとも大多数の内臓性求心性線維は後根から脊髄に入る。しかしながら、いくつかのケースでは、後根の切除は有効ではなく、他の求心性線維の経路が考えられている。
内臓痛の線維が交感神経に沿って走ると言うことの例外は、例えばS状結腸や直腸、膀胱のneck、前立腺、子宮頚部などの場合である。このような部位の内臓痛を伝える線維は,S2-4の後根から脊髄に入る。同様に、末梢ではこれらの線維は副交感神経に沿って走る。(膀胱の底部や子宮底部の痛みの線維は、例外で、下腹神経叢からTh11-L1にはいる。迷走神経が内臓痛を伝える線維を含むかどうかについては論争があった。外科的な経験によればこれはなさそう。Balchum and Weaver (1943)は胃からの内臓痛の線維は迷走神経ではなく内臓神経にはいることを示した。
内臓の病気が、体表のある領域の痛みだけを伴う、あるいはそれと共に内臓に起因する痛覚を伴うと言うことは、妙な現象であり未だ答えのでていないところが多い。関連痛の発生は臨床家にとってよく経験することである。例えば、肝臓や胆嚢疾病時の肩甲骨下部の痛み、胃潰瘍の上腹部の痛み、腎結石(?)の鼠径部や精巣の痛みなどである。この体壁の痛みは様々な臓器の疾患において限局した皮膚領域に現れる。この皮膚領域は知覚過敏であり、血管運動性の変化も同時に見られる。このような症状は実際の痛みがなくとも起こりうる。このような皮膚領域はこれに関する基礎研究をしたHenry Headに因んで一般にhead zoneと呼ばれる。ある臓器に関係する皮膚領域は、おおむねその内臓に交感神経線維を供給している脊髄の髄節から発する体性感覚神経の分布域と一致する。従って、胃の皮膚領域は、通常左側のだいたいTH5-9の皮膚節に一致する。このとき、噴門部は上部に幽門部は尾側に投影される。肝と胆嚢は右のTh7-9、虫垂と盲腸はTH10-12である。仙髄に痛覚の線維を送る内臓の場合、皮膚領域はその仙髄の髄節の皮膚説に一致する。
関連痛は内臓疾患に特異的なものではない。胸膜や腹膜の炎症や深部の筋、関節、靱帯、骨膜の損傷などでも起こる。様々な関連痛は多くの共通の特徴を持つが、これは基本的な痛みの発生機構が同じであることを示している。
通常関連領域の痛みは、割と位置がはっきりした最初の痛みが消えたあとに現れる。関連痛は局所的な痛みが消えたあとでも続くのである。知覚過敏などの皮膚の変化同様痛みは、必ずしも予期された皮膚節にのみ分布するのではなく、より広い範囲に起こることがある。個体差である(これは交感神経線維の分布の解剖学的違いに基づく)。この個体差は、健康な人のinterspinous ligamentに高張食塩水のような刺激物質を注射することによって実験的に関連痛を研究した人たちによって明らかにされた。刺激部位を麻酔すると、必ず関連痛と知覚過敏夜勤の痙攣が消失するが、関連痛の部位を麻酔しても痛みは消えない。後者は関連痛やこれに伴う変化に対する末梢因子の役割に関して興味があるところだ。
関連痛の機構を明らかにするために様々な試みがなされた。皮膚領域に関連痛が起こるのであるから、内臓のインパルスは皮膚の感覚神経線維あるいは神経路に伝えられるはずである。Mackenzieは内臓の疾患に伴って起きる非常に強い刺激は、その刺激が入る脊髄の髄節の灰白質の感受性を亢進させ、その結果普段は意識に昇らないインパルスを強め知覚できるようにしてしまうのではないかと考えた。これによれば、関連痛の起こる皮膚領域の知覚過敏を説明できる。内臓性求心性線維の異常な刺激は、その領域の血管運動性の変化などを説明する。また、筋のreflex rigidityは前角細胞に同様の刺激が伝わったためかもしれない。Hinsey and Philips (1940)はMckenzieの概念をより正確に体系づけようとした。彼らは、内蔵性も体性求心性線維も共に共通の二次ニューロンに刺激を伝えると仮定した。この神経機構は単純ではない。脊髄内部の機構も重要だが、最近の知覚線維の通過経路の詳細な研究やシナプスの部位の研究は脊髄より上位の関与も重要であるらしい。
関連痛の機序ははっきりしないが、これは内臓疾患の診断の上では重要な課題である。内臓が発する痛みに対処するために外科的な処置が必要な場合、内臓知覚に関する情報も重要である。
内臓痛の特殊な例である血管感覚についても考察が必要だ。先に述べたように血管にも神経支配がある。臨床的に示されているように、その中の一部は知覚性である。無麻酔の血管の結紮は痛い。例えば塩化バリウムのような刺激物質を実験的に血管に入れると、その血管の神経支配が生きていれば痛みを発し、血圧が上昇する。このような神経線維が血管に沿って走るのは比較的短い距離で、すぐにこれを離れてもとの神経束に戻る。これらの線維の神経細胞体は内臓知覚の線維と同様脊髄神経節にある。臨床的経験からしかし、血管知覚線維の一部や内臓知覚線維の一部は交感神経管を通って脊髄神経節に至る事実上全経路で血管に沿って走っている様に思われる。
自律神経系障害の症状。視床下部と脳幹の障害
自律神経系の構造に関する理解が未だ不十分なので、当然このようなシステムの病気の理解も進んでいない。実際のところ、自立系以外の構造に起因する病気においてさまざまな症状を生じる過程への自立系の関与は明らかであるが、自立系の障害が原因であると考えられる病気は少ない。大脳皮質と視床下部の関連は緊密であり、これはいわゆる機能障害や神経症の治療の際には意識すべきである。前項まで自律機能の障害とさまざまな自律系の組織の障害に伴う症状について考えてきた。これまで記載してきたことに関してはここでは簡単に触れることとし、これまで扱わなかった問題について主に論じたい。
視床下部の障害に伴う症状に関してはこれまでかなりの記載をした。次の症状のうちいくつかは最も良く見られるものである:尿崩症(視索上核あるいは下垂体茎の傷害)、心機能、血管運動性の傷害、脂肪性器性ジストロフィー(隆起核あるいは腹内側核の傷害)、消化管の出血と潰瘍。さらにHorner症候群や情動の変化もおきるかもしれない。狭い領域であるということとその位置のため視床下部の傷害はその隣接する組織、例えば視索、視交叉や下垂体にたびたび傷害を与える。
視床下部は脳底の骨折で傷害を受けることがある。このような場合ある患者には尿崩症が起こる。Fetal acute closed head injuriesの際は視床下部の障害が起こることが多い。原発性あるいは転移性のがんが影響することもある。原発性腫瘍としては頭蓋咽頭腫やsuprasellar meningeomasが重要。視床下部には血管系が発達しているが血管の病変に由来する視床下部の障害はまれである。内頚動脈や大脳動脈輪の動脈瘤が視床下部を圧迫することがある。視床下部にもっと頻繁に見られるのは感染症の影響である。流行性脳炎の視床下部に与える影響については第4章で記載した。梅毒性の髄膜炎による影響もよくみられる。アルコール性の脳障害の場合にも視床下部の傷害が報告されている。Korsakoff病の場合乳頭体に明らかな病変が見られることが多い。進行性の白質萎縮症も視床下部と関連があるとされている。慢性の胃潰瘍や十二指腸潰瘍では視床下部に多発性の微小な出血があることもある。また胃がんの患者では、慢性のアルコール中毒患者に見られると同様の病変が乳頭体に見られるという報告がある。Bakerらはポリオにより視床下部が影響を受けるとしている。115例の臨床病理学的検査から彼らは高体温、低体温、胃出血などの視床下部の機能障害が急性期に見られること、また回復後も数ヶ月あるいは数年にもわたる軽度の障害があることなどを示した。
橋や延髄の損傷は、脊髄や脳幹の自律神経節前ニューロンに投射する下降線維を遮断する場合がある。これは橋や延髄の外側部の障害において特に問題となる。このような線維路の遮断直後は傷害部位の同側下位の自律神経反射が失われる。従って、傷害側では無発汗症や立毛の喪失、さらには一般的に言って血管拡張が起こる。その後は、centrum ciliospinaleへの線維の遮断によるHorner症候群が明らかとなる。しかしこのような症状は次第に目立たなくなる。左右の半身間の皮膚温度や発汗も差がなくなってくる。立毛反射は通常傷害側で亢進する。これは脊髄の自律神経細胞群の活動に対する中枢性の制御が消失したためであると説明されている。
脊髄の損傷。The conus syndrome
第3腰髄より上位の脊髄の損傷(刺傷、銃創、棘突起の骨折による圧縮、脊髄内の腫瘍、横断脊髄炎)では、もしこれが側索を含むとすると、自律系の下行線維を遮断する可能性がある。このような傷害において、障害部位よりも下の髄節で仲介される自律神経系の脊髄反射は亢進する場合がある。既に述べたように立毛反射は同側性であるが、血管運動性反射と発汗反射は脊髄の正中をまたぐ反射弓によって仲介されている。従って、後者の変化はたとえ傷害が一側に限られているとしても両側性に現れため診断上の重要性も低い。このような場合は、立毛反射のほうが診断上多くの情報を与える。しかし立毛障害を起こす脊髄の髄節と症状の見られる体表の領域とは必ずしも一致しないということに注意が必要だ。脊髄の横断性の傷害は既に触れたように自発的な膀胱の制御を不可能にする。以下再び仙髄より上位の脊髄損傷における膀胱の症状について簡単に述べることにする。
自律系線維の下行路の遮断によって生じる症状の他Th1からL2の間の脊髄損傷は一般的に言って中間外側核の節前ニューロンを破壊する。しかし、そのような損傷による症状はある時間が経つと弱くなる。さらに、傷害部位が狭い範囲にある場合は症状がはっきりしなくなる。
上位胸髄の傷害では節前ニューロンに起因する症状を起こしやすい。例えば、もし上位2胸髄節が冒されるとHorner症候群は障害側に起こる。もしさらに2-3髄節下位まで冒されると、血管運動、発汗、立毛反射の消失は顔だけではなく同側の腕にも及ぶ。汗の分泌はこの領域では消失し、傷害が起こってから数日後欠陥の拡張が起こってくる。このような症状は、特に頚髄や上位胸髄に起こりやすい脊髄空洞症において見られる。初期はしかし発汗過多や血管収縮のような交感神経の興奮症状がみられる。個々の脊髄神経節は脊髄のいくつかの髄節から線維を受けているので、数個の髄節が冒されないと脊髄の自律神経反射は明らかにはならない。下位胸髄と上位腰髄が冒されると、ここに書いたような症状は下肢に起こる。既に述べたように、脊髄の血管運動性や発汗反射の消失は時間とともに回復する。これは局所的な自律反射が強調されてくるからである。男性の射精障害は下位胸髄と上位2腰髄の傷害によって起こる。
脊髄の仙髄レベルでの傷害は特に重要である。このような時現れる症状はconus syndromeといわれる。体性症状は中・下位仙髄の皮膚節あるいは筋節に現れる。これは、外肛門括約筋、膀胱括約筋、坐骨海綿体筋、球海綿体筋など骨盤外の筋の弛緩性麻痺である。感覚の麻痺は会陰や肛門外口の周辺、あるいはいわゆるsaddle anesthesiaの様な大腿後部に起こる。副交感神経の節前線維の細胞体や線維の破壊は膀胱の麻痺を起こす。麻痺した膀胱は尿の蓄積に従って膨張し、自動的に空にされることはない。しかしあまりに膨張しすぎると短時間ごとに少量の尿が漏れて排泄さる。これは膀胱を空にすることはない。随意的な排尿ももちろん障害されるが、上位の脊髄のときは随意的排尿が主に機能しなくなるのと違って、円錐部の障害では、反射的な排尿も起こらなくなる。膀胱の機能障害に加えて、仙髄からの副交感神経支配を受ける直腸やS状結腸の麻痺も起こる。自発的排便が起こらなくなるばかりか、外肛門括約筋が麻痺するため失禁状態になる。しかし時間が経つと直腸のある程度の自動性が回復する。これはおそらく末梢の自律性に基づくものらしい。最後に副交感神経の節前線維と体性運動性線維の損傷のため、男性では勃起と射精機能が失われる。しかし精管と精嚢の運動線維は交感神経なので精液の放出は起こる。(この精液の放出は横紋筋である坐骨海綿体筋や球海綿体筋も必要とするので通常の射精では起きない) 脊髄円錐部の傷害の進展時でも、細胞が一部残っている場合は仙髄の内臓性、体性運動性細胞の興奮により持続性勃起症が起こることがある。円錐部の障害が不完全である場合はこのような症状の一部のみがみられるだろう。つまり勃起や射精機能は障害されても、膀胱機能は殆ど正常というようなことが起こる(dissociated conus syndrome)。Conus syndromeはS2-4に二次的に影響する脊髄損傷によっても起こるということもある。膀胱の反射機能が保存される脊髄損傷の傷害部位の下限はL4であるといわれている。
脊髄円錐部の傷害とまったく同じ症状が当該部位からの遠心性線維の損傷によっても起こる。一方後根の障害により膀胱の求心線維のみが損傷したときにも膀胱反射が損なわれる。これは脊髄ろうtabesのときによくみられる。このようなことから明らかなように馬尾神経の障害は脊髄円錐部の傷害と同じ症状を表す。しかし馬尾神経の損傷は仙髄神経ばかりではなく腰神経の障害も含むことが多いので、感覚や運動の麻痺はより広い範囲に及ぶ。さらに脊柱管内の腫瘍の場合のように馬尾神経の一部は損傷を逃れることがあるので、障害の発生部位は不規則となる。
脊髄の横断性傷害における膀胱機能障害については以前簡単に触れた。脊髄の外傷や多発性硬化症などのときにみられる通り横断性障害は頻度が高いので臨床的に興味を集めた。それゆえここでもう少し記載したい。既に述べたように仙髄より上位の脊髄損傷の急性期には脊髄ショックが膀胱に影響し尿が溜まる。ショックが収まると膀胱は自動的に機能するようになる。対麻痺(両下肢、下体幹麻痺)の患者では脊髄反射のための構造は上位の制御なしに働くのである。(正常な状態では排尿反射はその中枢を橋に持つらしい。ところが横断性脊髄損傷の患者では自動的な排尿はS2-4に中枢のある反射弓を介して行われるのである。)このとき排尿反射は正常よりも起こりやすく、一端起こると外括約筋の随意運動によって排尿をとめることは出来ない。損傷部位よりも下位の刺激、例えば冷却や接触、あるいは会陰や大体の内側部を針で刺したりすることが排尿反射を引き起こすことがある。これはいらいらする現象だが下半身麻痺の患者では排尿を促す有効な手段となる。反射の亢進には外括約筋が多くの場合関与する。痙攣性の下半身麻痺の患者においては外括約筋が完全に弛緩しないことが筋電図でわかる。このことは排尿の抵坑を高めるため排尿を不完全にする。(このようなときは。外科的に外括約筋に分布する神経の切断が有効)。
半身麻痺では膀胱機能が亢進することもある。このようなときは副交感神経の影響を減少させるアトロピン系の薬剤が有効。一方、手術後の一過性の排尿障害や物理的な障害を伴わない慢性的な膀胱機能低下にはコリン作動性の薬剤の投与が有効である。前項で示したように交感神経系も排尿に多少関与する。脊髄損傷の位置のより膀胱機能への影響が異なるのは障害部位が交感神経線維を膀胱に送っているかどうかによって異なる。
末梢の自律神経系の障害
交感神経幹の損傷は脊髄の中間外側核の傷害と同じ症状を生み出す。ただしこの場合体性運動、感覚神経の障害は伴わない。はっきりした症状を生み出すには交感神経幹のある程度広範囲の障害が必要なのであまり起こることはない、しかし、頚部や腰部の交感神経幹の障害はたとえ限られた範囲の障害であっても頭部や尾部の症状を生み出す。このうち最もよく診断されるのが上部胸神経節、下頚神経節、星状神経節の障害である。既に述べたように、このような部位の障害は同側の頭頚部や上肢の発汗、立毛を消失させ、血管を拡張させる。もし下頚神経節が冒されるとHorner症候群が現れる。このようなことは実際には戦争時の銃創などでよく見られる。障害が徐々に進行する場合の初期は血管収縮、発汗、立毛などの交感神経系の亢進症状がみられる。胸腔や腹腔の内臓に分布する交感神経線維の切断は通常はっきりした症状を示さない。
脊髄神経の神経叢の障害はこのシステムに含まれる交感神経系の働きを傷害する。例えば腕神経叢の傷害では分節状の血管拡張、皮膚の乾燥、立毛の消失が見られる。興奮性の傷害では、血管収縮、発汗の亢進など症状はもっとはっきりする。多発性神経炎では興奮性の症状は欠損症状とともに現れる。しかし、麻酔によって末梢神経が麻痺した状態でもあるびまん性の感覚が残るという特殊な状態がある。一般的に言って、この種の感覚は針でさしたり、強い圧迫を加えることで最もよく理解できる。ある場合は、例えばカウサルギーのように微弱な接触や圧迫が強い痛みを生むこともある。このような感覚は血管に伴行する感覚線維によるものと考えられている。
末梢の自律神経叢の傷害に起因する病気というものはない。しかし、実験動物やヒトの例から、多くの疾病において見られる幾つかの症状は内臓神経の障害に起因していることがわかる。
自律神経系の手術
病気の成因が不明である場合殆どの手術は理論的な推測に基づいて行われる。交感神経系の手術は殆どすべての疾病について行われてきた。血管評価は異なる。多くの場合手術は手に負えぬ痛みを除くために行われる。
交感神経の切除は様々な方法で行われる。Periarterial synpathectomyは血管周囲の交感神経叢を除く方法である。このとき血管の外膜がある程度の範囲にわたってはがされる。多くの場合交感神経除去を行った場合、その末梢部分の血管の拡張は一過性であり、また痛みの除去も不十分である。これはたぶん既に記したように、大血管から遠く離れたところでは血管はその周囲の組織から交感神経線維を受けるからだろう。交感神経線維の再生や、交感神経を除去された組織の液性因子に対する感受性の増加などの可能性が考えられている。
交感神経幹や神経節の除去により体のある部位に対する交感神経刺激を完全に取り除くことが出来る。これは一般にganglionectomyといわれる。問題の領域に線維を送る白交通枝の切断も同様の効果を与える。このramisectionは非常に繊細な手術で白交通枝だけでなく下位白交通枝も切断してしまうことが多い。交感神経節の切除はある場合は節前線維の切断と同じであることがある。例えば下肢への交感神経を除去するために上部腰神経節を切除する場合がそうだ。この場合、下位腰部や仙骨部の節後線維は影響されない。
交感神経切除術後も多くの医師が交感神経の影響が消失しない部位があることを経験している。Monro1959をみよ。
Monroは交感神経切除の効果を皮膚抵抗を指標として調べた。星状神経節と第2胸神経節を除くcervicodorsal sympathectomyでは顔の中央に切除の効果が見られない領域があった。第4胸神経節から第3腰神経節までを除去するthoracolumbar sympathectomyでは第1、第2腰髄に相当する皮膚節かあるいはもう少し広範囲の発汗が残った。会陰もこの効果を逃れた。正常人の臨床解剖学的および解剖学的検査からMonroはthoracolumbar sympathectomyの効果が及ばない範囲は、その範囲に分布する神経根(灰白交通枝)中にintermediate gangliaがあるからだと考えた。L4とL5の神経根は節前線維が切断されることになるので発汗は起こさない。なぜ会陰部に交感神経切除の影響が及ばないのかはよくわからない。Monro's monograph (1959)には臨床的に興味のある多くの観察が記載されている。彼は交感神経切除はthoracolumbar sympathectomyのほうがcervicodorsalよりも満足すべき結果を与えるとしている。
通常手術を行う前に診断のための局所麻酔が行われる。例えば、問題の神経節にプロカインを注入するといったような。このプロカインブロックは神経伝達を完全にとめるので、プロカインの効果が不十分であれば手術をしても満足する結果は得られない。一方例えば痛みに対するプロカインブロックは予想より永く効くことがある。そしてプロカインの反復投与は完全に痛みを取り除くこともある。このような場合プロカインは"悪循環"を断つのだとされている。
交感神経節の摘出と同様の効果はアルコールやフェノールを神経節に注入することでも得られる。この方法はしかし効果が短い場合があるし、周辺組織に対するダメージも大きい。注射の際の肋間神経の損傷はしばらくして神経痛を起こす。そのほかの方法としては、内臓神経の切断、下腹神経叢や上・下腸間膜神経叢の切除などがある。
自律神経系の手術は経験を重ねるにつれて効果が間違いなく期待できる場合だけに限られるようになった。薬物治療の進歩も手術の適用を少なくしている。以下今日ではあまり行われなくなったとしても、自立系の手術が有効であるとされたもののみについて記載したい。
一本のあるいは複数の四肢において症状の一因が異常な血管収縮によるという十分な根拠がある場合には交感神経切除が行われた。最も端的な例はRaynaud's diseaseである。
これは男性よりも女性に多く見られる病気で、つま先や手の指などからだの末端部の血管運動性の変化に起因し疼痛を伴う。寒冷や感情の変化が発作を惹き起こす。そしてこの間は手足に寒さを感じ、しばしばチアノーゼとなる。手足の冷却は小動脈の収縮によるし、チアノーゼは拡張した毛細血管の血流が停滞したために起こる。毛細血管は収縮し皮膚が青白くなることもある。痛みは鈍痛で感覚異常を伴うこともある。発作がおさまると皮膚は温かくなり赤くなるが、この血管の拡張の後は普通焼けるような痛みが襲う。発作がなかなかおさまらない場合は指先の壊死や真皮や骨の潰瘍や萎縮性変化などの回復しがたい変化が起こる。
この病気の成因は不明である。複数の因子が関与するのだろう。交感神経切除が有効なので、血管への交感神経線維が重要であることは間違いない。しかし、上肢に関して節前線維をきるか節後線維かで結果が異なる。Raynaud病に関しては節前線維をきるほうが結果がいい。
交感神経切除が末梢血管の病気に有効であるかどうかはその症状に血管痙攣を含まれるかどうかによる。血管の構造上の変化がある場合は大体効かない。Endarteritis obliterajsでは有効である場合もある。老人性あるいは糖尿病性壊疽の場合交感神経切除が行われた。治癒が促進された例もある。血管の痙攣によりkつ竜が途絶えたことに起因する慢性的な四肢の潰瘍の場合もそうだ。
最近の降圧剤の進歩以前は、高血圧の治療に広範囲の交感神経切除が行われ、何人かの人はよい結果を報告している。例えば内臓神経の切除など。
内臓神経の切除ははっきりした症状を示すことはない。これは腹腔の器官はかなりの自律性を持つという知見と一致する。内蔵機能の障害があるとき、治療目的で交感神経切除が行われた。これは交感神経系に起因する平滑筋の異常収縮が原因と考えられる疾患で有効である。例えば噴門痙攣や幽門痙攣など。消化器系については副交感神経系の支配について考えるべきだろう。迷走神経の切断、vagotomyは胃潰瘍や十二指腸潰瘍の患者に行われた。結果は一般的にいって満足すべきものではない。
この手術の主な目的は胃の感覚線維を切断することである。しかし迷走神経の切除は胃への運動線維を切断するし、そのほかの腹腔臓器への迷走神経支配も切断してしまう。従って、様々な合併症を生じる。最近では胃酸を産生する壁細胞が存在する範囲に分布する迷走神経の枝だけを切断するというような手術の改良がなされている。この胃選択的迷走神経切除術の結果は腹部迷走神経をすべて摘出することよりも有効であると報告されている。しかし潰瘍の再発も頻繁に認められる。これはおそらく迷走神経の再生によるのだろう。
内臓痛は関連する脊髄神経の後根切断か脊髄の切断により消失するが、体制の知覚神経を損傷することなしに内蔵痛を治療できれば明らかにそのほうがよい。従って内臓痛の手術は他の方法に頼らざるを得なくなる場合があるにしても自律系についてのみ行われる。狭心症の痛みは既にみた様に心臓の急進性線維によって運ばれると考えるべきである。これは交感神経線維によって伝えられるので交感神経節へのアルコール注入や交感神経節の切除などの手術によって解除される。しかしながら特に最近の自律系疾患に対する薬物療法が進歩したため、交感神経系の手術は行われなくなった。
心の求心性線維は最も低いレベルで第4か第5胸神経節に入るので、星状神経節ばかりではなく第4胸神経節まで摘出するのが基本である。この手術後も心機能に大きな変化は認められない。この手術には心の求心性線維がなくなることにより患者が心の発する危険信号を得られなくなるという心配がある。しかし狭心症の危険を知らせるに十分な拡散性の圧迫感や動機が術後も残る。
月経困難症には子宮の交感神経支配を切断する治療が行われた。この治療では大動脈から骨盤へ行く交感神経叢の切除が行われた。この手術は一般にpresacral neurectomyといわれる。月経困難症にはホルモン療法が有効であることがわかったので、この手術は現在は行われない。この手術はまた激痛を伴う膀胱や前立腺の疾病にも適用されたが、先に述べたような神経支配があるので結果は満足すべきものではない。悪性腫瘍の場合は腫瘍が周辺の組織に転移していない場合に限ってこの手術による痛みの除去が期待できる。これは転移した場合は体性知覚も関係するからである。上頚神経節の切除によって三叉神経痛の治療が試みられたことがある。しかし、三叉神経痛に交感神経が関与するという根拠もないし、今日では行われない。四肢の痛みを伴う疾患に交感神経切除が多くの患者で行われた。Causalgiaといわれる傷が神経を損傷するために起こる症状で、銃創のときに最も多い。多くは正中神経や坐骨神経の損傷に伴って起こる。
Causalgiaあるいはこれに類似の症状は他のタイプの興奮性神経障害でも起こる。この症状は受傷直後か治癒の過程で起こる。焼けるような悲惨な痛みは受傷部位よりも末梢側で起き、熱により増大し、冷却すると減少する。侵された部位は知覚過敏となり些細な刺激でもひどい痛みを生ずる。また四肢の運動や、敏感な患者では精神的な刺激によっても痛みの発作が起こる。知覚過敏の領域は原因となる神経の皮膚領域よりも広い範囲に及ぶことも多いが、このような領域では温度刺激や圧迫が痛みを起こす。典型的なケースでは傷害部位に外見上の変化が現れる。皮膚は赤く熱を持ち光沢がある。発汗が見られることもある。
この成因は明らかではない。多くの仮説が提出されたがどれといって満足なものはない。Richardによればこの症状特に焼けるような痛みは、受傷部位での交感神経系の遠心線維と体性感覚線維の異常な相互作用が原因であると考えるのが最もそれらしい。自然の回復が見込めないCausalgiaでは様々な手術や処置が試みられた。傷害部位よりも近位の神経へのアルコール注入、神経の切断、動脈周囲の交感神経除去、などであるがどれも大して効果がない。最も効果的だったのは傷害を受けた四肢に線維を送る交感神経節の切除である。上肢であれば頚椎、胸椎部分の神経節である。このような手術の結果は、77%がexcellent、19%がgood、4%がpoorである。
他の四肢の痛みを伴う疾病で、自律神経支配の障害が主な原因と考えられるものも手術が行われたが結果は思わしくない。しかしながら、このような病気の本体は不明である。四肢の障害に伴って起こる受傷後の栄養失調であるとか、痛みを伴う骨粗しょう症などと称される。このような症状と典型的なcausalgiaとは常にはっきりした区別はない。
四肢切断の後殆どの患者は切断した腕や足がまだ存在するような感覚を持つ。これはphantom-limbといわれ様々な知覚を生ずる。ある患者ではphantom-limbの領域に激しい痛みが数週間あるいは数年も続くことがある。Phantom-limbの成因は複雑でよく理解されていない。この神経機構については、Melzack(1974)を参照。心理的な要素が関与することは間違いない。様々な手術がこの症状に対して行われたが多くの場合無効であった。最近の薬物療法の進歩は自律神経系に対する手術の適応機会を減少させた。この先更なる進歩が期待されている。
これまで自律系の末梢部分の手術について述べてきたが、中枢レベル、特に視床下部にも治療目的の手術の適用がある。既に述べたように視床下部は情動表出や行動に関与し、拮抗的に働く中枢を含んでいるので、治療目的でその一部の局所的破壊が行われた。長期にわたって制御不能の凶暴な攻撃性を示す患者で、他の治療が無効である場合は、精神外科的な手術が行われた。この手術は攻撃的な行動を示す精神発達遅延の患者に特に有効であるとされる。破壊するのは両側の後部視床下部である。その部位は交感神経を興奮させるような刺激に反応する部位である。
前部視床下部の破壊はhedoniaに適用される。これは個人的欲求(食欲、飲酒、喫煙、性行動)を満足させたいという衝動を制御できない状態である。異常に強い感情がこの状態の基本的な特徴である。この手術はアルコール依存症や小児性愛などの逸脱した性行動に有効であるとされた。興味深いことに、主な不都合は食欲の亢進である。実験的に証明された様々な性中枢の存在に基づいて、視床下部の特別な小領域を破壊することによってある性行動に影響を与えることが出来るとするヒトもいる。
視床下部の主な求心性・遠心性線維の結合、その構成を考えると、またさらに限定された領域と特定の機能を結びつけることの難しさを考えると、psycosurgicalな視床下部の切除はあまり理がないようだ。psycosurgeryについては12章でまた述べることにする。

最終更新日:2002/09/13
