
神庭重信・川村光毅

精神分裂病と躁うつ病は、かつては2大精神病とよばれ、脳に明らかな形態異常が認められない疾患として捉えられてきていた。しかし、近年の神経科学の進歩、とりわけ分子遺伝学的研究、画像解析、そして神経解剖・生理・化学の進歩により、精神病といえども機能的・構造的異常を伴う脳の疾患にほかならない、という理解に至っている。とはいえ、その理解は、いまだ不十分であることは否めない。また、これらの精神疾患の病理を神経科学的に解明しようとする試みは、とりもなおさず脳について、なかでも精神と脳とのかかわりという最大の謎にせまる1つの道筋であると理解されるべきであろう。

4-4-1 精神分裂病 |
|
| 文 献 |

精神分裂病(以下、分裂病)と躁うつ病(気分障害)は、かつては2大精神病ともよばれ、精神疾患のなかでも際立った疾患として捉えられてきた。それは、多くは若年に発症し、苦悩に満ちた自覚症状を生み、精神機能の障害の重さゆえに、社会生活全般にゆゆしい影響をひき起こし、しかも慢性に経過しがちであるという特徴をを共有しているからである。近年では、有効な治療薬が次々と開発されてきてはいるが、いずれも対症的治療にとどまり、疾患を根治するには至っていない。もちろんこれは、の病因・病態が十分に解明されていないからにほかならない。
これらの疾患の病因・病態を考えるときに、その遺伝(内因)と環境(外因)の影響を無視することはできない。そして今日まで積み上げられてきた研究結果は、両者の影響が脳の機能と構造に影響を生み、上述した特徴を有する表現型としての精神疾患を生み出す、という可能性を指し示している。この基本的理解の上に、本節では、分裂病と躁うつ病について、その遺伝研究、画像や死後脳研究から示唆される神経解剖学的知見、そして神経化学的知見について紹介したい。

分裂病(ある亜型)が遺伝性の疾患であることは、従来からの家族研究、双生児研究、養子研究によりほぼ確実なことと考えられている。数多い分裂病の生物学的知見のなかでも、分裂病の遺伝性は科学的根拠の最もしっかりした事実である。
Sherringtonら(1988)の研究に端を発した近年の分子遺伝学的研究の流れは、全ゲノムをスキャンする徹底した検索をもって行われているが、結論を述べると、まだ決定的な遺伝子は発見されていない。
現時点で可能性が高いと考えられているのが第6染色体であり、短腕領域との連鎖の報告があいついで報告されている(Straubら、1995;Antonarakisら、1995;Sasakiら、1995)。ただし、支持された遺伝マーカーの分布にかなりの広がりがみられ、また同染色体との連鎖に否定的な結果もいくつか報告されている。また第22染色体も注目されているが、これはvelocardiofacial
syn-drome(VCFS)のおよそ10~22%に妄想型分裂病に似た精神病が起こること(Shprintzenら、1992)、そしてこの先天異常が染色体22q11領域の遺伝子の1.5~2Mb程度の微小欠矢(deletion)によることが判明したからである(Scamblerら、1992)。さらに、染色体22q11-13領域と分裂病との関係は、連鎖解析や同胞対照法(sib
pair study)(Gillら、1995)で弱いながら示唆されている(Coonら、1994;Pulverら、1994;Polymeropoulosら、1994;Valladaら、1995;Schwabら、1995)。ただし最近では、VCFSに関連して躁うつ病が多く現れるという報告もある。
分裂病の原因遺伝子の候補をドーパミン受容体、アドレナリン受容体、チロシン水酸化酵素、神経成長因子、接着因子に求めて多くの検討が加えられたが、決定的な発見には至っていない。このなかで、古くから分裂病で注目されているドーパミンD2受容体に関して興味深い知見が有波、糸川らにより報告され、国際的に注目を集めた(Itokawaら、1993;Arinamiら、1994)。ただし、その後に行われた追試では、同様の結果(Shaikhら、1994)と否定的な結果(Gejmanら、1994;Ashersonら、1994;Nankoら、1993)が報告されており決着をみていない。

かつて、分裂病は脳に器質的異常をみない謎に包まれた疾患であると考えられた時期もあった。AlzheimerやSpeilmeyerなどの神経病理学の先駆者たちが精力的に分裂病に取り組んだにもかかわらず、その病理は明らかにされず、分裂病の神経病理学的研究は至難の技と考えられた。1960年代、立津政順らを中心とする研究者たちは、特殊な銀染色技術を開発し、分裂病者に特徴的な脳病理所見を報告した(立津、1967)。要約すると、軸索の肥大化、硬化、乱雑な配列、神経細胞の周囲の空隙が狭い、神経細胞およびその核が大きい、などの所見であった。立津がとくに注目したと思われるのは、軸索の走行の乱れであり、それがとくに前頭葉に強く認めれたことであった。下記に述べるように、この着眼の優れていたことは、後世の神経病理学者たちの手によって示されたといえよう。
CTの登場により、脳室拡大所見が発病初期にすでに認められ、しかもその程度が病前の不適応と関連することが明らかにされた。この初期のCT研究は、その後の分裂病の発達障害仮説を導いた点で重要な意味があった。そして、脳画像解析技術あるいは神経病理学のさらなる進歩により、分裂病は脳のミクロなレベルでの器質的異常を伴うものであることが明らかにされつつある。
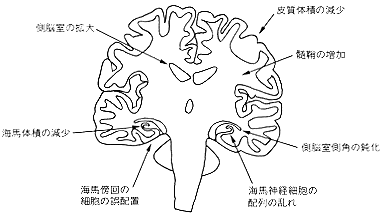
図1 分裂病に見いだされている脳病理所見 (Heyman, I. et al., 1992より引用)
図1に、今日比較的一致した所見として認められている事実をまとめた(Heymanら、1992)。形態学的には、側脳室の拡大、内側側頭葉構造の容積減少が、局所脳血流では、両側前頭葉上部、両側前頭葉中部での低下が、左側視床、基底核、両側帯状回前部、右側下前頭野での増加が認められている。前頭葉の機能低下は陰性症状と関連があるとされ、幻聴の聞こえている際には、側頭葉、左海馬、海馬傍回、右側線条体で強く活性が認められている。
死後脳の剖検でもよく一致した所見が得られている。平均で、脳の重量が健常者に比べて5%軽いこと、脳室の拡大、側頭葉、とくに海馬、海馬傍回などの側頭葉内側の容積の低値はよく一致した結果である。また、背内側視床、線条体、脳梁の容積の減少なども報告が多い。
扁桃体は、ここで注目される側頭連合野と前頭前野眼窩皮質を含むかなり広範囲にわたる皮質連合野ならびに海馬と連絡をもち、価値・評判の判断をするうえで重要な部位である。そして、視床下部を経て、情動の表出が形成される。分裂病の本質は、精神内界の失調あるいは知・情・意の解離ではないかとみなされることがある。川村(1993)は、分裂病の研究を進めるにあたり、連合野と辺縁系、なかでも扁桃体あるいは視床下部との機能的統合の障害に着目することの重要性を協調した。
表1 一卵性双生児で、分裂病について不一致例での脳画像と神経心理学的機能

WCST: Wisconsinカード分類検査
(倉知ら、1996を一部修正のうえ引用)
一卵性双生児の不一致例で画像と神経心理学的所見をまとめたものが表1である。これらの研究は、遺伝子上の問題にその後に何らかの環境要因が加わって発症に至ったことを示唆している。環境要因として注目されているのが、妊娠中に母親のインフルエンザへの罹患、出産時の産科的合併症であり、これらの頻度が分裂病患者で有意に多いことが知られており、いずれも脳の発達形成障害に結びつけられて議論されることが多い。
さらに細胞構築を調べると、海馬の錐体細胞の配列に不整が認められており(Kovekmanら、1984)。これは細胞の移動(migration)に欠陥が生じた可能性を示唆している。また嗅内野(entorhinal
cortex)の細胞群の誤配置もみつかっている(Jacobら、1986)。これらの所見は、妊娠初期から中期にかけての胎児の脳の形成時期に、神経細胞が移動し最終的な配置につく発達過程で起きた異常ではないかと考えられている。分裂病の脳病理所見に、一般的にはグリオーシスが認められないことも、この発達時期の障害であることを支持する結果となっている。すなわち、神経細胞発生(neurogeneisis)はグリア発生(gliogeneisis)に先立って起こり、妊娠初期から中期はまさに神経細胞発生の時期であり、この時期に加わる障害はグリオーシスを生じないと考えられるのである。また、神経細胞の移動に際しては放射状グリア(radial
glia)との相互作用が重要であり、ここでは細胞接着因子(Cell adhesion
molecule;CAM)の役割が重要であるため、分裂病でCAM遺伝子の検索が行われている。
また、小児期にピークとなるシナプスの数は、思春期になると30~40%減少するという。この時期に一致して、分裂病が好発することから、シナプスのpruningと分裂病とのかかわりも注目されている(Feinbergら、1983;Kasharanら、1994)。実際に、シナプスと関連するリン脂質であるシナプシンやシナプトフィジンが分裂病患者の内側側頭葉で低下しているとの所見が報告されている(Eastwoodら、1995)。あるいはまた、神経網(neuropil)の容積や樹状突起の棘(spine)の数の減少も報告されている(Selemonら、1995)。

抗精神病薬が臨床力価と比例したD2型ドーパミン(DA)受容体遮断作用をもつことや、アンフェタミン類、コカインなどのDA作動薬が、精神分裂病(分裂病)様の幻覚・妄想状態を惹起する事実に基づいて、分裂病では、脳のDA伝達が亢進しているのではないかと推定されてきた。ここでは、DA系についての新たな知見およびN-メチル-D-アスパラギン酸(NMDA)受容体について明らかにされたことを中心に紹介したい。
Seemanらは1993年に、分裂病死後脳の線条体ではD4受容体が著しく増加していることを示した。錐体外路性副作用が少なく、陰性症状もある程度改善するクロザピンが、10-9~10-8nMのオーダーの高い親和性を示す唯一のDA受容体サブタイプがD4受容体であることから、この発表は大きな反響をよんだ。しかしながら、その後の追試の結果は一致をみていない。
最近は、D2ファミリーの受容体ばかりでなく、D1型DA受容体の変化も分裂病の認知障害との関連性の点から注目されている。すなわち、前頭前野のD1受容体は、記憶や認知機能に関係することが明らかにされているが、分裂病患者では認知課題遂行時の帯状回の活性化が障害されており、この低活性はDA作動薬のアポモルフィンの投与によって改善される、Okuboら(1997)はPETを用いた研究で、前頭前野のD1受容体結合能が有意に低下していることを見いだした。この低下は、未服薬の患者に限っても有意であり、陰性症状の強さと逆相関していた。また、Wisconsin
Card Sorting Testで遂行障害を示す患者群のほかが顕著であったという。
しかしながら、ドーパミン系の異常だけでは、抗精神病薬が疾患の進行を満足にはくい止められないことや、陰性症状が薬物反応性に乏しいなどからも、分裂病の病態の多面性を説明できそうにない。病因を考えるならば、ドーパミン系の異常が結果なのか原因なのか、発症準備性における役割があるとしてそれは何か、ドーパミン遮断薬で発症が予防できるのかなどの疑問が残されている。
さらに近年、乱用者に分裂病様の陽性・陰性双方の症状をひき起こすフェンサイクリジンがNMDA型興奮性アミノ酸受容体の強力な遮断薬であることが明らかにされ、グルタミン酸、アスパラギン酸などの興奮性アミノ酸による伝達異常も、分裂病症状の発現に関与している可能性も考えられるようになった。たとえば、分裂病患者の死後脳のNMDA受容体サブユニットやグルタミン酸の代謝異常を示唆する所見も報告されている。一方、ラットの脳のスライスで抗精神病薬(ハロペリドールとクロザピン)がNMDA受容体機能を促進する現象も見いだされている。したがって、将来的には、NMDA受容体機能に作用する物質が陰性症状にも効果を及ぼす可能性があるのではないかと期待されている。

1987年のEgelandらの報告以来、気分障害の遺伝子を発見しようとする試みは盛んに行われてきたが、最近も数多くの報告がなされた。なかでも最も注目されたのが、Nature
Genetics 4月号(1996)に一挙掲載された3報であろう。Blackwoodらは、双極性障害をもつ12家系を対象に連鎖研究を行った。ある家系で、全ゲノムをスキャンし、193のマーカーについて調査した結果、第4染色体短腕にあるD4S394と名づけたマーカーと有意な連鎖を報告した(2点ロッド値4.1,3点ロッド値4.8)。また残る11家系をあわせて解析した結果でも、D4S394との連鎖が認められた。アーミッシュの家系を対象として、全ゲノムをスキャンしたGinnsらの報告では、第6、13、15染色体と双極性障害との連鎖が推定され、その遺伝形式は多くの遺伝子が効果を及ぼす多因子遺伝であろうと結論している。第3報のFreimerらは、コスタリカの2つの大家系を連鎖解析と関連解析で検索し、第18染色体長腕(18q22-23)と双極性障害との有意な連鎖を見いだした。しかしハプロタイプを調べた限りでは、単一遺伝子による単純な優性遺伝形式では説明できないとしている。気分障害と第18染色体との連鎖は、古くは1994年のBerrettiniらの報告に始まり、さらに昨年にはベルギーの研究グループ(De
Bruynら、1996)およびユタ大学のグループ(Coonら、1996)からも類似の報告がなされており、かなり注目される領域ではないかと思われる。
抗うつ薬の作用点の1つであるセロトニントランスポーター(5-HTT)の遺伝子、また古くから気分障害の原因研究において注目されることの多いノルアドレナリン生合成の律速酵素であるチロシン水酸化酵素(TH)の遺伝子に注目した研究も数多く報告された。しかし、結論には至っていない。

a.躁うつ病と前頭前野
無感情、意欲の欠如、無為、無気力など、うつ病の中核症状と類似の症状は、前頭前野の障害によってもみられる。このことから、Georgeら(1994)は、前頭前野の一時的な機能障害がうつ病に起こっており、うつ病でみられるそのほかの症状は、前頭葉と辺縁系などとの機能統合が障害される結果ではないかと推定した。
MRI(magnetic resonance imaging)による検討では、前頭前野の容積が、健常者(76名)に比べて、重症のうつ病患者(48名)では7%少なかったという報告がある(Coffeyら、1993)。MRS(magnetic
resonnance spectroscopy)で同部位に生化学的異常を報告した研究も数多い(加藤、1996)。フルオロデオキシグルコースを用いたPET解析で脳代謝率を調べたBaxterら(1989)の報告では、左前外側前頭前野(ALPFC)での糖代謝率や局所脳血流が、すべてのうつ病患者で健常者に比べて低下していた。しかもうつ病の重症度と糖代謝率との間に負の相関がみられ、うつ病が改善したときには糖代謝率も改善したという。前頭前野、なかでもALPFCの血流の低下も数多く報告されている。高齢うつ病患者ほど左前頭葉の血流低下が著明であったという報告もある(Austinら、1992)。Maybergら(1994)は、再発性で治療抵抗性の重症うつ病患者において、前頭葉、側頭葉前部、帯状回前部、尾状核の両側性の血流低下、なかでも前頭葉下部、側頭葉前部、帯状回などの傍辺縁皮質での著明な血流低下を認めている。
精神作業による賦活試験も行われている。EIliottら(1997)は、ロンドン塔問題とよばれる、計画を立てて遂行する作業を与え、脳局所血流量を調べた。その結果、健常者にみられる右前頭前野、尾状核、帯状回前部での血流増加が、うつ病患者では著明に減弱していることを見いだした。
再発性家族性うつ病(躁病の家族歴がない)と双極性障害(躁病相)患者を対象として、PETを用いた脳血流と糖代謝率の測定にさらにMRIによる容積の測定を組み合わせて厳密な検討を加えたDrevetsら(1997)の研究が最近報告され、話題をよんだ。彼らは、帯状回前部に位置し、脳梁膝に接して腹側に局在する無顆粒皮質領域(脳梁膝下野、subgenual
prefrontal cortex)において、双極性障害うつ病相で血流および糖代謝の低下を認め、単極性うつ病患者で糖代謝率の低下を確認した(図2)。また躁病患者では逆に、同部位の代謝率の増加を認めた。さらに、MRIで同部位の容積を測定したところ、双極性障害および単極性障害ともに、健常者に比べて容積が小さいことが判明した。この容積の違いは、病相が緩解しても変化はみられなかった。これらのことから、この器質的変化は脳の発達障害であり、躁うつ病の脆弱性と結びついているのか、あるいは再発を繰り返した結果生じた2次的は器質的変化なのかのどちらかであろう、と著者らは推論している。
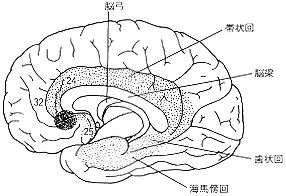
図2 大脳半球の内側表面
点を打った領域が辺緑葉。歯状回は多少誇張した。これらは、原始皮質、古皮質、中間皮質を含む。今回Drevetsら(Nature,
386, 824-827, 1997)により、躁うつ病患者で以上が発見された部位(図中濃い網かけで示した)は、Broadmann
area 24, 25, 32を巻き込んだ部位である。
前頭前野は大脳基質核や辺縁系などと密接な神経ネットワークを形成しており、これらのループ機能の障害が躁うつ病の広範囲にわたる臨床症状の形成に重要な役割をもつのかもしれない。あるいは、前頭前野の機能障害が、皮質下の障害により2次的に生じている可能性も十分考えられる。そこで以下に、躁うつ病の皮質下の構造について行われた研究を紹介したい。
b.躁うつ病と皮質下構造
(1) 扁桃体
内臓感覚は直接に、ほかの感覚は視床あるいは感覚連合野を介して、すべての感覚が扁桃体に入ってくる。そして、これらの感覚刺激の価値評価と意味認知に深くかかわっているのが扁桃体である。扁桃体は視床下部と下位脳幹との間に密接な線維連絡をもち、情動の表出(情動行動、自律神経反応、内分泌反応)にも重要な働きをしている(Aggletonら、1986)。
Drevetsら(1992)は、単極性うつ病患者を対象に、[H215O]PETを用いて、血流変化を解析し、左扁桃体における血流に増加を認めた。前頭前野と扁桃体との間には同側性の繊維連絡が存在すること、また扁桃体が感情の制御に深くかかわっていることから、扁桃体の機能異常がうつ病と深くかかわっていることが推定された。
(2) 尾状核
尾状核をはじめとする大脳基底核とうつ病との関係は、この部位に器質性
あるいは機能性変化を起こすハンチントン病や多発性硬化症あるいはパーキンソン病に感情の障害が多くみられることから、古くから関心がもたれてきた。Drevetsら(1992)の上述の研究では、両側尾状核の血流低下も認められており、この結果はBaxterら(1985)らの結果ともよく一致している。
(3) 海馬
かつてAxelsonら(1993)は、うつ病患者で、血中コルチゾールレベルの高値と海馬の萎縮の程度との間に相関を見いだしていた。1996年になって再発性うつ病患者(Shelineら、1996)とベトナム戦争のために心的外傷後ストレス障害を呈した患者(Gurvitsら、1996)において、MRIでの海馬に萎縮がみられることがあいついで報告された。海馬は、グルココルチコイド受容体が密に分布している部位であり、うつ病で機能の亢進がみられるHPA系(hypothalamo-pituitary-adorenal
axis)へ、ネガティブフィールドバックをかける重要な部位と考えられている註1)。動物実験では、グルココルチコイドが海馬錐体細胞を傷害することが示されている。慢性うつ病や過度のストレスがグルココルチドの過剰な分泌をひき起こし、2次的に海馬の萎縮を生じたとすれば、注目に値する所見といえる。
c.躁うつ病のモノアミン仮説の現状
モノアミンを枯渇するレセルピンにうつ病を惹起する作用が知られ、また三環系抗うつ薬がモノアミン(とくにセロトニンとノルアドレナリン)の再取り込みを阻害する作用を有していることから、うつ病は、脳内モノアミンが減少して起こり、逆に躁病は過剰になったために起こるのではないかと考えられた。このいわゆるモノアミン仮説は、抗うつ薬の作用発現に数週間がかかる事実をうまく説明できなかったため、抗うつ薬を動物に長期投与して起こる、(おそらく2次性の)シナプス後受容体のダウンレギュレーションと抗うつ薬の作用機序が注目されている。しかしながら、肝腎のうつ病や躁病で、実際に脳内のモノアミン伝達が上記の仮説どおりの状態にあるのか否かの検討はほとんど行えないでいる。
脳脊髄液におけるモノアミンの代謝産物を測定した研究では、うつ病患者でセロトニンの代謝物5-HIAAの低値を認めたが、現在ではこの所見はむしろうつ病でみられる自殺衝動性を説明する結果ではないかとの見方が強い。今後機能的画像診断技術の進歩により、脳内伝達物質の動きが十分な空間的・時間的分解能をもって観察できる時期を待って最終的な決着が下されるであろう。

精神分裂病や躁うつ病についてのわれわれの知識は、過去数十年のうちに飛躍的に増加した。どちらの疾患の形成にも、遺伝と環境が重要であることが改めて確認されてきた。しかしながら、両者のかかわりの仕組みはほとんどわかっていない。また、報告された異常についても、その特異性はもとより、異常をもたらした原因や病因とのかかわりについてもほとんど明らかではなく、これらの発見をもとに統一的な仮説を提示できる段階には至っていない。
そもそも疾患の境界が不鮮明であるうえに、現在われわれが用いている精神疾患の診断に妥当性があるのかすら未知である。たとえば、分裂病と重症の躁うつ病は同一家族内に集積することが認められている。そして、分裂病にしても躁うつ病にしても、類縁の疾患、たとえば分裂病でいうならばパラノイア、分裂病質人格障害、分裂病型人格障害などの分裂病スペクトラムにあげられるカテゴリーをどう捉えるのかで、臨床遺伝学的解析の結果に大きな違いが現れる。いまだにEinheitspsychose(単一精神病)が捨て去られていないのもうなづけよう。
今後神経科学はさらに目覚ましい発展を遂げていくことだろう。そして、この学問の進歩を背景として、精神症状の表出にとくに重要な神経回路とその形成(とくに細胞構築)にかかわる遺伝と環境の影響を、個の生命の始まりの時点から縦断的に観察し、因果関係を明らかにしていく必要がある。これらの難問を解決することは、とりもなおさず脳について、しかも精神と脳とのかかわりという最大の謎にせまる1つの道筋でもある。
註1)
視床下部-下垂体-副腎系(HPA系)は自律神経系と並ぶストレス応答システムである。周知のように、Selyeは、副腎から放出されるグルココルチコイドは、危急反応において生体防御的に作用することを明らかにした。また、グルココルチコイドは海馬に高密度に分布するステロイド受容体に結合し、視床下部へネガティブフィードバッグをかけ、ストレス応答を弱める作用をもつ。ところが、グルココルチコイドが過剰に、かつ長期にわたって高いレベルにあると、海馬錐体細胞の細胞障害につながることが示されている。うつ病では、HPA系の機能亢進が長期間認められることが多い。この結果、慢性あるいは再発性のうつ病では海馬に障害が起こると考えられている。

1) Jones, P., Murray, R. M.: Br. J. Psychiat., 158, 615-623(1991)
2) 加藤進昌・高橋清久:精神疾患の分子遺伝学、生物学的精神医学、Vol.
3, 学会出版センター(1993)
3) 川村光毅:認知機能についての機能解剖学的考察、生物学的精神医学,Vol.
4, pp. 183-198, 学会出版センター(1993)
4) 神庭重信:躁うつ病の脳科学、星和書店(1995)
5) 倉知正佳・鈴木道雄:精神疾患の脳画像解析-精神分裂病を中心に-.精神疾患の脳イメージング(融 道雄編),pp.
5-22, ライフサイエンス, 1996.
6) Mtthysse, S., Levy, D. L., Kagan, J., Benes, F. M.:
Psychopathology:The evolving science of mental disorder, Cambridge University Press(1996)
7) 西川 徹:Clin. Neurosci., 14, 955-958(1996)
8) Risch, N., Botstein, D.: Nature Genet., 12, 351-353(1996)
9) Rutter, M., Plomin, R.: Br. J. Psychiat., 171, 209-219(1997)
10) Schizophrenia Bulletin, The neuroanatomy of schizophrenia, Vol 23,
No.3(1997)
11) 塩江邦彦・神庭重信:躁うつ病の生物学.精神医学レビュー97(風祭 元編),pp.26-32,
総合医学社(1997)
12) 立津政順:精神医学9, 5-10(1967)
13) 融 道雄:精神疾患の脳イメージング,
ライフサイエンス(1996)
14) Waddington, J. L.: Lancet, 341, 531-536(1993)

脳と神経 分子神経生物科学入門(金子章道、川村光毅、植村慶一編、共立出版会社、1999発行)
338頁―345頁より許可を得て転載