
湯浅茂樹 川村光毅

| はじめに | |
| I.小脳発生における細胞移動と層形成 | |
| II.外顆粒層の移動機序 | |
| III.プルキンエ細胞の発生、移動機序と接着因子 | |
| IV.小脳発生における神経回路形成 | |
| おわりに | |
| 文献 |

中枢神経の発生過程において、神経管の脳室に面した未分化神経上皮細胞は分裂をくりかえしている。このうち、最終分裂を終えた神経芽細胞は皮質に向かって移動を開始する。皮質に到達した神経芽細胞は層構造を形成するとともに、突起を伸ばして特定の標的神経細胞とシナプスを形成し、神経回路網の形成が行われる。未分化で、混沌とした神経原基から、高度の組織化された神経系が形成される過程において、上記の細胞移動と標的認識の機序に関わる種々の細胞成分、細胞外基質、細胞表面分子が、時間的ならびに空間的に協調して発現する。そして、その大部分は神経系が完成すると消失するか、あるいは痕跡をとどめるのみとなる。このような共通した機序が、幼若な中心神経系の各部位で、時期と様式を異にして発現し、また各部位に特異的な分子の発現とも相まって、各部位に特異的な構造と機能が賦与されていく。このような形態形成過程において重要な役割を演ずる、細胞間および細胞-基質間の相互作用に関与する分子には特異的接着活性をもつものが多く、これらの分子の発現様式や作用機構と発現の制御は神経発生生物学における中心課題の一つである。本稿においては、齧歯類の小脳発生過程を軸にして、個々の過程の現象に対応して発現する細胞接着因子(図1)およびそれに関連する分子の意義を、筆者らの成績を含めて概説したい。
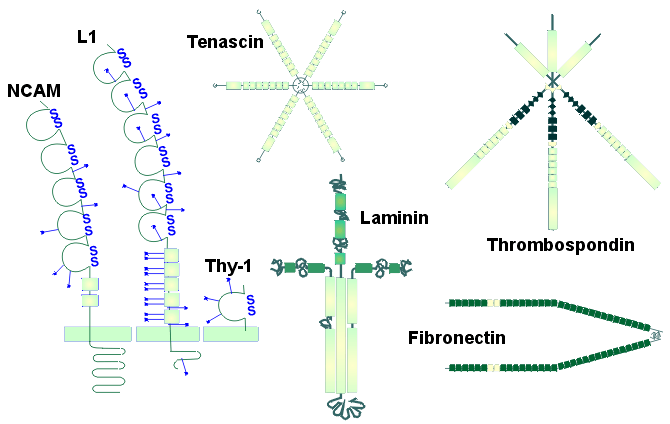
図1 小脳発生に関与する細胞接着因子の構造(文献24より改変)
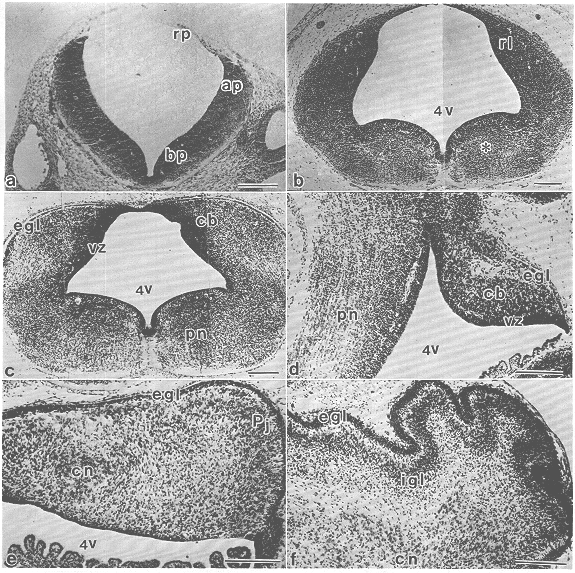
図2 マウス小脳原基の発生過程(Nissl染色像)
a. 胎生9日の菱脳胞の横断面。神経管壁がroof plate(rp,蓋板)、alar
plate(ap,翼板)、basal plate(bp, 基板)に分化している。b. 胎生11日の原基水平断面。翼板は背尾側方向に発達してrhombiv
lip(rl, 菱脳唇)を形成し、腹吻側方向に発達して脳幹(*)を形成する。4V:第4脳室。c.
胎生12日の原基水平断面およびd.
矢状断面。菱脳唇はさらに発達して小脳原基の構造が明瞭になる。cb:小脳原基、vz:ventricular
zone, egl:外顆粒層、pn:橋。c. 胎生18日の原基横断面。外顆粒層(egl),プルキンエ細胞層(Pj)、小脳核(cn)が明瞭となる。f.
生後2日小脳横断面。内顆粒層(igl)の形成認められるようになる。scale
bar=200μm。
1. 小脳原基の由来
神経管の各分節から前脳胞、中脳胞、菱脳胞が形成される。このうちの菱脳胞の側壁の神経管が増殖、肥厚して翼板(alar
plate)が形成される。翼板の一部は背側に向かって発達し、このようにして形成された神経上皮組織から小脳原基の原型である菱脳唇(rhombic
lip)が形成される。これに対して翼板から産生される神経芽細胞の一部は腹側に向かって延髄、橋に移動し、小脳求心線維の起始核群を形成する3)。このようにして、同一部位から生成した神経芽細胞が別々の部位に移動したのち、再び特異的な結合を形成する。翼板内でおのおのの細胞の運命がどのようにして決定されるのか、あるいはおのおのの細胞の運命の決定は周囲の環境によって変更しうるか、また、相互の特異的結合形成に関わるシグナルがいかなる発生段階でどのように発現するかなど、小脳原基の形成の初期の段階は、移植実験、遺伝子導入によるcell
lineageの標識など新たな発生生物学的手法で挑戦すべき問題を含んでいる。
2.
小脳原基の形成と各細胞成分の発生、移動、配列
菱脳唇は層形成の不明瞭な多列上皮細胞組織から形成されている。この未分化は段階から、次第に脳室に面した神経上皮細胞の分裂、増殖と軟膜表面への細胞移動により、ventricular
zone, subventricular zone, intermediate zone, mantle zoneからなる幼若な神経組織の層構造が形成されてくる。この神経上皮で分裂増殖をくりかえしている細胞のうち、最終分裂を終えた神経芽細胞が表層に向かって移動し、分化して小脳を構成するニューロンとなるが、各ニューロンの最終分裂時期は異なっている28)
表 マウスの小脳を構成する細胞の最終分裂時期(文献26より改変)。
| プルキンエ細胞 | 胎生11~13日 |
| 室頂核の大型ニューロン | 胎生11~13日 |
| 室頂核の小型ニューロン | 胎生13日~胎生末期 |
| ゴルジ細胞 | 胎生12~15日 |
| 顆粒細胞 | 胎生末期~生後15日 |
| 白質内のグリア細胞 | 出生直後~20日 |
神経上皮で発生した神経芽細胞が表層に向かって移動し、皮質に配列して層構造を形成するのが中枢神経系の発生の基本的パターンであるが、小脳発生過程においてもプルキンエ細胞、小脳核ニューロンはこの様式で発生し層形成を行う。さて、小脳発生で特徴的な点は、表層の軟膜直下に、分裂能を有する外胚芽層(external germinal layer)が形成される点である。そして、この二次的に形成された外胚芽層から、外顆粒細胞、籠細胞(basket cell)、星状細胞(stellate cell)が形成されると考えられている。これらの細胞は、外胚芽層でおのおのの運命が決定されたのち、原始皮質表層の軟膜下から深層に向かって移動し、basket cell, stellate cellは分子層内へ、外顆粒細胞は内顆粒層へ移動して最終的に小脳の皮質層構造が形成される。ここで、外胚芽層の形成機序に関しては、現在大きく分けて2つの考え方がある。ひとつは、小脳原基の脳室に面した神経上皮の外側部のうち特に尾側部分に特定の領域germinal trigoneを想定するものである。この部分はsecond rhombic lip(二次菱脳唇)ともよばれ、この部分からは背側に向かって移動する細胞によって小脳外顆粒層が形成され、腹側に向かって移動する細胞からは蝸牛神経核が発生すると考えられている42)。このgerminal trigoneにおいては、脳室に面した神経上皮と表層の軟膜が接しているため、ここで生成したneuroblastは直接表層に達し、そこから軟膜直下を内側および吻側に向かって接線方向(tangential)に移動し、小脳原基の最外層全域に分布するという考え方である2)。もうひとつの考え方は、第4脳室面の神経上皮、内胚芽層から表層へ向かって移動したneuroblastが軟膜下に配列して、二次的に分裂能をもつ外胚芽層を形成するというものである17)。この場合、neuroblastは小脳原基内の細胞成分の間を放射状に移動して行くことになり、二次的に形成された胚芽層の細胞の発生段階としては、移動後も分裂能をなお保持するという意味で、subventricular zoneに近いと考えられる。二次的に形成された外胚芽層は分裂能を維持するため、内胚芽層あるいはgerminal trigoneを3H-thymidineあるいはbromodeoxyuridineで標識しても標識が希釈されて、移動経路を追跡することが困難であり、どちらの形成機序が主体をなすのかは、外胚芽層を形成する細胞に特異的に発現するマーカーをみいだして、その移動様式を明らかにすることが必要である。なお、Golgi細胞の発生母地に関しては、第4脳室面神経上皮とする考え方28)と外胚芽層とする考え方19)があり、未だ定まっていない。

II.
外顆粒層の移動機序
中枢神経発生過程において神経上皮で最終分裂したneuroblastは皮質へ向かって移動する。あるいは、小脳外顆粒細胞層、海馬歯状回原基においては二次的に形成された胚芽層から最終的な層形成部位へのneuroblastの移動が認められる。このような特定の方向へ向かっての細胞移動の機構として、①脳室面から表層の軟膜下まで突起を伸長しているradial
gliaの突起に接触することにより、皮質の層形成部位まで移動を誘導されるcontact
guidance,あるいは二次的に形成された胚芽層から、astrogliaの突起に接して層形成部位まで移動を誘導されるcontact
guidance(gliophilic guidance)18)、②神経線維に接して移動が誘導されるcontact
guidance(neurophilic guidance)20)、③脳室面と表層軟膜との間に細胞突起の両端がすでに接しており、細胞核とその周辺が脳室面から表層へ向かって移動し、その後で脳室両側の突起が収縮、乖離する場合(perikaryal
translocation)4)、および、④特定の構造物による誘導は認められず、移動経路に発現する細胞接着因子による誘導、あるいは何らかの誘引物質の濃度勾配による誘導43)が考えられている。このような細胞移動の過程においては、すべての場合に共通して、移動細胞の表面とそれが接する細胞構造あるいは細胞間質との間にみられる接着(attachment)と乖離(detachment)のcycleと、これに同期した移動細胞の細胞膜成分のrecyclingが起こる5)。したがって、神経発生過程において起こる細胞移動の機構として、細胞接着因子の発現と分布、局在様式の解析が中心的な問題となる。
小脳発生過程のみならず、哺乳類の中枢神経発生過程でneuroblastの移動における細胞の接着ならびに乖離の機能の研究においては、小脳外顆粒層の内顆粒層への移動過程(図3)が最も集中的に研究されている。外顆粒層においては、顆粒細胞は軟膜下で分裂増殖しており(external
germinal layer, proliferative zone),この内、分裂を終えた神経芽細胞はpremigratory
zoneを形成する。
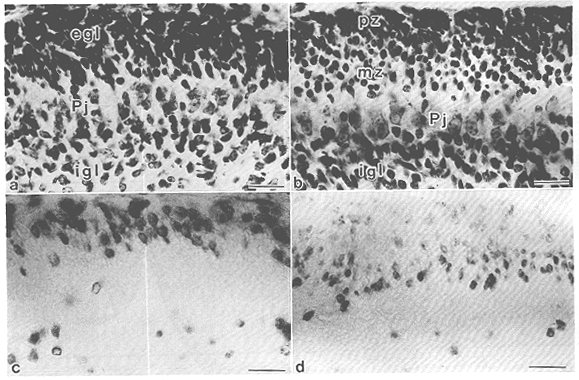
図3 マウス新生仔小脳における顆粒細胞の移動
生後1日のマウスにbromodeoxyuridine(BrdU)を腹腔内投与し、一定時間後に矢状断面標本を作製して抗BrdU抗体により免疫染色を行った。
a. 生後1日のマウス小脳皮質Nissl染色像。egl:外顆粒層。Pj:プルキンエ細胞層。igl:内顆粒層。b.
生後3日のマウス小脳皮質のNissl染色像。生後1日の皮質と比較して、内顆粒層を形成する細胞の著明な増加が認められる。pz:proliferative
zone, mz: migratory zone, c. 生後1日のマウスにBrdUを投与して1時間後の小脳皮質内における標識細胞の分布。aの隣接切片。標識細胞の大部分は外顆粒層の浅層部分(proliferative
zone)に分布する。d. 生後1日のマウスにBrdUを投与して40時間後の小脳皮質内における標識細胞の分布。bの隣接切片。標識された細胞はmigratory
zone,プルキンエ細胞層を通過して移動しつつあり、一部の細胞はすでに内顆粒層に分布している。scale
bar=20μm
このpremigratory zoneから、神経芽細胞は分子層内を移動し、プルキンエ細胞層を越えて深層に至り、内顆粒層が形成される。なお、分子層内には、プルキンエ細胞層に細胞体が位置し、突起が軟膜下まで伸びたastrogliaの一種であるBergmann
gliaが存在し、外顆粒層より移動するneuroblastは、このBergmann gliaの突起に接して移動すると考えられている。小脳にみられるこの移動は、齧歯類では生後3週間の間に起こり、中枢神経系内の他の部位では、この時期には、すでにほとんどの細胞移動は終わっている。小脳外顆粒層の移動は、explant
cultureや、granule cellとgliaを分離後、再度一緒に培養する(co-culture)実験系でneuroblastの移動が観察できるため、多数の接着因子をはじめ、細胞移動に関与する因子の作用の検証の対象となっている。特に、これらの因子に対する抗体あるいは阻害剤が顆粒細胞の移動に及ぼす効果の観察が行われてきた7,9)。このような実験系でこれまで、neuroblastの移動に関与することが明らかにされた細胞接着活性を有する主な分子として、NCAM(neural
cell adhesion molecule)、Ng-CAM(L1)、cytotactin(tenascin, J1)、AMOG,
thrombospondin, astrotaction, cerebellar soluble lectin(CSL)などがある。
このうち、NCAM 7,9,10)は最初にみいだされた細胞接着活性を有する膜局在性糖タンパクである。タンパク質部分の構造は免疫グロブリンと相同であり(immunoglobulin
superfamily)、細胞内ドメイン、細胞膜貫通ドメインと細胞外ドメインから成る。細胞外ドメインに糖鎖が結合する。NCAMの遺伝子はひとつであるが、mRNAのalternative
splicingによりタンパク質部分における多様性が生じ、結合する糖鎖の種類によっても多様性が生じて、この組合わせにより、NCAM分子の構造ならび接着活性の多様性が、発生の各段階に応じて発現する。齧歯類成体の中枢神経系では分子量が180kD、140kD、120kDのNCAMが発現し(図4)、胎生期の脳では180kDと140kDの分子種が発現する。
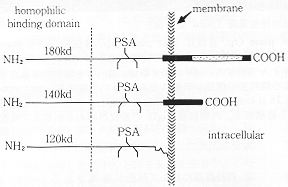
図4 NCAMの各分子種の構造上の相関関係(文献9より改変)
各分子種のN末端領域の構造は同一であるが、細胞膜に結合するC末端領域の構造は、各分子種で異なっている。140kDの分子種には膜貫通領域が存在し、180kDの分子種には、さらに細胞内領域が附加されている。120kDの分子種はphosphatidylinositolを介して細胞膜に結合している。PSA:polysialic
acidの結合部位を示す。
180kDと140kDの分子種は膜貫通糖タンパクであるが、120kDの分子種は膜貫通糖ドメインを欠き、phosphatidylinositolを介して細胞膜に結合する。胎生期の脳にはα-2-8結合したpolysialic acidを分子量の30%含むNCAM(NCAM E form)が発現するが、成体の脳では、NCAMのpolysialic acidの含量は10%に減少する(NCAM A form)。NCAMは、これを発現した細胞同士間の接着、homophilic bindingに関与しており、細胞外のN末端部分には接着活性が局在する。なお、polysialic acid含量の高いNCAM E formではNCAM A formに比べて接着活性が30%程度に低下している。180kDの分子種の細胞内ドメインは細胞内骨格タンパク質fodrinと結合する能力があり、細胞接着による情報を細胞内に伝達する可能性がある。マウス小脳において、出生直後から生後3週の間にみられる外顆粒層の移動時期にはNCAM E formが発現し(図5a, b)、移動が終了する時期になるとNCAM A formへの発現の変換が起こる。この移動過程においては、NCAM E formは外顆粒層の増殖部位(proliferative zone)には発現していないが、premigratory zoneに入ると外顆粒細胞で発現が認められるようになる。分子層内を移動中の顆粒細胞では、細胞体にもleading processにもE formが発現しているが、内顆粒層に至って移動が終了すると、顆粒細胞の細胞体からはE-formは消失する。しかし、軸索と樹状突起においては、シナプス結合が完成するまでその発現は持続する。また、Bergmann gliaの突起にも、この移動の時期にE-formが発現している。このような、移動過程におけるNCAM E formの発現は、その接着活性の低下により、neuroblastとgliaの突起とのcontactを保ちつつ移動が可能な状態を作りだしているものと考えられる。Explant cultureで、外顆粒細胞から分子層内への移動に対して弱い移動阻害効果が認められている6)。
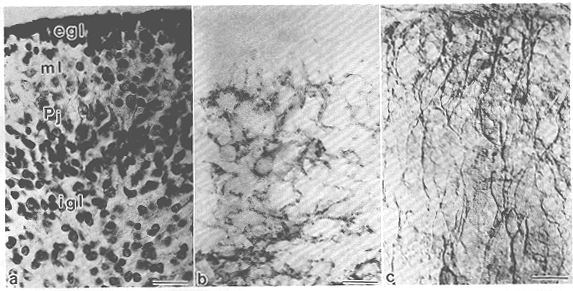
図5 生後2日のマウス小脳皮質矢状断面における細胞接着因子の発現
a. Nissl染色像。egl:外顆粒層、ml:分子層、Pj:プルキンエ細胞層、igl:内顆粒層。b.
隣接切片の抗NCAM-H抗体40)による免疫染色像。分子層から内顆粒層にわたって、細胞の突起構造ならびに一部の細胞体にNCAM-Hの発現が認められる。c.
隣接切片の抗tenascin抗体による免疫染色像。radial gliaの突起状にtenascinの発現が認められる。scale
bar=20μm
Neuron-glia cell adhesion molecule(Ng-CAM)7,9,10)はニュ-ロンとグリアの間の細胞接着活性を指標としてchick脳よりみいだされた糖タンパクで、分子量が135kDの主成分とともに200kD、80kDの分子種も含まれる。200kDの分子種の前駆体として、これから135kDと80kDの分子種が生成すると考えられている。マウス脳の膜糖タンパクのひとつとしてみいだされたL1はNg-CAMと類似した分子であり、両者とも構造上、NCAMと同様に免疫グロブリンスーパーファミリーである。Ng-CAM,
L1は最終分裂を終えたニューロンに発現する。Ng-CAMは、これを発現したニューロン間のhomophilic
bindingに関与する。さらに、Ng-CAMを発現したニューロンはグリアに接着するが、この場合グリア上のNg-CAMに対するリガンドは不明である。これに対して、L1はニューロン間のhomophilic
bindingには関与するが、ニューロン-グリア間の接着には関与していない。Ng-CAM,
L1は外顆粒細胞の移動過程で、premigratory zoneと分子層内を移動中のneuroblastにおいて、その細胞体とleading
processに発現する。しかし、NCAM E formとは異なって、Bergmann glia上には発現せず、また移動中のneuroblastにおいてはBergmann
gliaと接した側には発現せず、他のニューロンと接する面にのみ発現する。このような発現様式から、Ng-CAM,
L1は顆粒細胞間の相互作用に関与するものと考えられる。Explant
cultureにおいて、外顆粒層の移動過程に抗Ng-CAM抗体あるいは抗L1抗体を作用させると、premigratory
zoneから分子層内へのneuroblastの移動が強く抑制されることが報告されている6)。
Cytotactin7,9,10)はtenascin, J1と同一あるいは相同性の高い分子で、6本のsubunitが一点を中心に放射状に配列し、各subunitの外縁の末端に接着活性に関与するdomainがある。Cytotactinは最初、chick脳でみいだされ、J1はマウス脳、tenascinはchick線維芽細胞でみいだされた。これらの分子は、astrogliaによって合成、分泌される糖タンパクで、neuronとgliaの接着に関与する16)。糖鎖として、モノクローン抗体HNK-1で認識される硫酸化グルクロン酸を含む。胎生期の脳には分子量が220kD、200kD、190kDの分子種が含まれ、成体脳では160kDの分子種が主成分となる。Cytotactin分子は、fibronectin
typeIIIに相同なdomain, fibrinogenに相同なdomain, epidermal growth factorに相同なdomainから成り、接着因子としての機能だけでなく、成長因子としての活性も発現する可能性をもっている。Astroglia上のcytotactinを介して接着するニューロンの表面には、cytotactinに対するligandとしてchondroitin
sulfate proteoglycanが発現している。Cytotactinは小脳で外顆粒細胞の移動時期に、Bergmann
gliaの突起上に発現する(図5a,c)。Explant cultureにおいては抗cytotactin抗体の添加により、premigratory
zoneから分子層表層へのneuroblastの移動は影響を受けないが、分子層内のより深層におけるこの細胞の移動は強く阻害され、分子層内に顆粒細胞が蓄積する6)。したがって、抗cytotactin抗体は移動中の顆粒細胞とBergmann
gliaとの相互作用を阻害していると考えられる。
生後マウスの小脳顆粒細胞をウサギに免疫して得られた抗血清は、培養系において顆粒細胞とradial
gliaとの接着を阻害した。この抗血清によって認識される顆粒細胞の膜表面タンパク質のうち、NCAM,
L1とは異なり分子量100kDの糖タンパクがみいだされ、astrotactinと名づけられた11)。Bergmann
gliaによるcontact guidanceに障害があって、顆粒細胞の移動が阻害されているweaver
mutant mouseの小脳ではこのastrotactinが正常マウスの5%以下に減少していた。顆粒細胞とastrogliaを分離した後、再度混合して培養する実験系において、正常マウス由来の顆粒細胞はweaver由来のastrogliaの突起上を移動できるが、weaver由来の顆粒細胞は正常マウス由来のastrogliaの突起上を移動できない18)。この結果から、astrotactinは顆粒細胞膜がBergmann
gliaの突起へ接着する過程に関与して細胞移動を促進すると考えられている。
生後発達過程にある小脳内に、mannoseを特異的に結合する可溶性レクチン(endogenous
cerebellar soluble lection, CSL)が見出されている。小脳内にはこのレクチンの内因性リガンドである糖タンパクが複数あり、このうち31kDのものが幼若な顆粒細胞の細胞膜表面とBergmann
gliaの突起上に局在する。生後発達過程の小脳切片のexplant cultureを用いた実験系で、このレクチンに対する抗体または31kDの内因性リガンドに対する抗体を加えると、外顆粒層の顆粒細胞の内顆粒層への移動が阻止された25)。この結果から、外顆粒層のBergmann
gliaの突起によるcontact guidanceにおいて移動顆粒細胞表面とグリアの突起表面の両者に局在する内因性リガンドに可溶性レクチンが結合して、両者間の接着に関与していると考えられている。
Adhesion molecule on glia(AMOG)7,9)は、齧歯類小脳のアストログリアの膜表面に存在する分子量50kDの糖タンパクで、ニューロンには発現していない。抗AMOG抗体は、in
vitroで小脳ニューロンとアストログリアの接着を抑制する。また、生後発達過程の小脳切片のexplant
cultureに抗AMOG抗体を加えると、顆粒細胞は外顆粒層から分子層内への移動するが、分子層の深部に蓄積して、内顆粒層への配列が阻止された。AMOGの接着活性はheterophilicであると考えられるが、ニューロン上に発現するAMOGのリガンドは、未だ同定されていない。
ニューロンが方向性をもって移動するためには、グリアの突起あるいは細胞外基質と移動ニューロンとの接着による相互作用と、細胞間あるいは細胞-基質間の接着部位の分解による移動性の獲得との均衡が必要であろう。齧歯類小脳において、生後、顆粒細胞の移動が活発な時期にセリンプロテアーゼに属するtissue
plasminogen activator(tPA)ならびにplasminが産生されるが、成体小脳では産生が認めたれなくなる。生後発達過程の小脳切片のexplant
cultureに、tPAあるいはplasminに対する阻害剤を加えると外顆粒層から分子層への細胞移動は強く抑制された29)。さらに、125Iで標識されたtPAは小脳顆粒細胞に高親和性に結合し、アストログリアには結合しないことが示されている44)。以上の知見より、顆粒細胞膜表面に結合したtPAが小脳内のplasminogenを活性化し、活性化されたplasminogenが自己触媒的にplasminを産生して、細胞間あるいは細胞-基質間の接着部位を分解することにより27)、細胞の移動性が高まると推察される。
Thrombospondinは細胞接着活性を有し、主に細胞外基質に局在する糖タンパク分子である。この分子は、plasminogenおよびtissue
plasminogen activatorと結合して、tissue plasminogen activatorによるplasminogenの活性化を促進する。Thrombospondinは顆粒細胞の移動過程において、Bergmann
gliaに接したleading processに局在し、Bergmann glia突起には発現していない。Explant
cultureにおいては、抗thrombospondin抗体を添加することにより外顆粒細胞のpremigratory
zoneから分子層内への移動が阻害される33)。これらの点を総合すると、thrombospondinは、顆粒細胞のleading
processがBergmann gliaの突起へ接着するのを促進することとと、plasminogenの活性化を介して接着部位の構造を分解することにより、接着と乖離のサイクルを促進することによって、細胞移動過程に関与すると考えられる。
以上に、外顆粒細胞の内顆粒層への移動機序に関与する種々の接着因子とその関連物質の主なものについて言及した。ニューロンとグリアとの間の接着と乖離のサイクルを基本におく細胞移動には、これらの多数の分子が協調的に作用していると考えられる。Cytosine
arabinosideをマウス新生仔に投与することにより外顆粒細胞の移動の異常を実験的に引き起こした場合、小脳内でpolysialic
acid含量の高い胎児型NCAMの発現が生後14日まで持続し、正常発生過程で認められるような胎児型NCAMから成体型NCAMへの発現の変換が遅れることが知られている。そして、移動が障害された外顆粒細胞で胎児型NCAMの異常発現が認められる32)。このようなNCAMの異常発現は、移動を阻害された顆粒細胞とBergmann
gliaとの間の異常な相互作用により引き起こされると思われる。
外顆粒細胞は脳室に面した神経上皮で発生し、移動後、外顆粒層を形成し、この位置でさらに分裂増殖する(二次的胚中心の形成)。この増殖は軟膜直下で起こるが、6-hydroxydopaminnを局所的に投与して軟膜を選択的に破壊すると、外顆粒細胞の増殖抑制、Bergmann
gliaのend feet(終足)の破壊が引き起こされる41)。軟膜を構成する細胞が産生する細胞外基質(laminin,
collagen type III, fibronectin)および液性因子には、外顆粒細胞の生存維持や成長促進の作用があるものと推量される。


図6 胎生14日目のマウス小脳原基におけるプルキンエ細胞の移動と細胞接着因子tenascinの発現48)
a. プルキンエ細胞のマーカーである抗spot35抗体47)による原基横断面の免疫染色像。脳室面神経上皮により皮質に向かって放射状に移動するプルキンエ細胞が認められ、一部のものはleading
processあるいはtrailing processを有する(矢印)。b. 隣接切片の抗tenascin抗体による免疫染色像。radial
gliaの突起上にtenascinの発現が認められ(矢印)、プルキンエ細胞の移動方向とradial
gliaの突起の配列方向が一致している。scale bar=20μm
プルキンエ細胞は第4脳室に面した神経上皮細胞から発生する。プルキンエ細胞の特異的マーカーであるspot35
47)タンパクに対する抗体を用いて免疫組織化学的に調べてみると、マウスでは、胎生11~13日に最終分裂を終えた前駆細胞が皮質に向かって放射状に移動を開始する。そして、胎生15日から17日にかけて、原基の皮質に数層からなるプルキンエ細胞層を形成していく。この層形成は原基の外側のほうが内側より早く進行し、また尾側のほうが吻側より早く進行する48)。マウスでは、生後1週間から10日頃までに、内顆粒層の形成に対応して、数層からなるプルキンエ細胞層は一層に配列していく。プルキンエ細胞の移動は、脳室面から放射状に突起を伸ばし、表層の軟膜直下にその終足が達しいるradial
gliaによって誘導されると考えられる。移動プルキンエ細胞とradial
gliaとの接触は電顕的にも確かめられている23)。このradial
gliaの突起上にはニューロン-グリア間の細胞接着因子tenascinが発現していることが免疫組織化学的に明らかにされた48)(図6,7)。
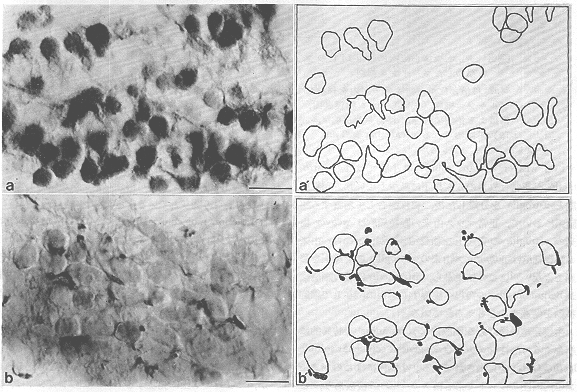
図7 胎生14日のマウス小脳原基の水平断面における、移動中のプルキンエ細胞とtenascin免疫反応陽性のradial
gliaの突起配列との相関。
a. 抗supot35抗体47)による免疫染色像。a'. aにおける移動プルキンエ細胞横断面の分布のcamera
lucida。b. aの隣接切片の抗tenascin抗体による免疫染色像。b'. bにおけるtenasscin免疫陽性性の突起横断面と、それに接する細胞体の分布のcamera
lucida。移動中のプルキンエ細胞とtenascin免疫反応陽性のradial gliaの突起との接触が認められる。scale
bar=10μm.
tenascin は、プルキンエ細胞の移動と層形成の活発な時期に対応してradial gliaの突起上に強く発現し、その後の発達過程で次第に弱くなる。また、ラットの小脳原基を成体ラット小脳内に移植すると、移植組織由来のプルキンエ細胞が宿主内へ移動する現象が認められるが22)、移動したプルキンエ細胞の周辺にはtenascinの発現が認められる(図8)。

図8 ラット成体小脳内に胎生14日のラット小脳原基を移植後、移植組織により宿主脳内へ移動したプルキンエ細胞
a. 移植部位から宿主分子層内を移動して軟膜下に定着した、spot35
47)免疫陽性の異所性プルキンエ細胞(矢印)。ps:軟膜表面、ml:分子層。b.
aの隣接切片の抗tenascin抗体による免疫染色像。移動した移植プルキンエ細胞の周辺に限局したtenscinの発現(矢印)が認められる。scale
bar=20μm
これらの所見から、幼若プルキンエ細胞の移動に、tenascinを介する細胞接着が関与すると考えられる。小脳原基のタンパク質を電気泳動後、Western blotを行い、発達過程におけるtenascinの分子量の変動を調べると、胎生期には分子量205kDと220kDの2つの分子種が認められ、特にプルキンエ細胞の移動が活発な時期に発現が増加する。しかし、成体の小脳では205kDの分子種は、もはや検出できなくなる48)。この胎生期に特異的に発現する分子種の構造と接着活性の検討が、プルキンエ細胞の移動機構の解明における重要な課題であると考えている。Reeler mutant mouseでは、遺伝性の中枢神経系の皮質形成異常が認められ、神経発生過程における神経芽細胞の移動障害が原因と考えられている。このmutant mouseの小脳原基においてプルキンエ細胞移動様式を観察すると、正常マウスでは皮質に向かって放射状に移動するのに対して、reelerでは移動を始めた細胞群がintermediate zoneで集塊を形成しており、移動が阻害されている像が認められる。このリーラーマウスの小脳原基におけるtenascin免疫陽性のradial gliaの配列は正常マウスと比べて乱れている。すなわち、分岐、交叉しており、neuroblastの移動が阻害されている像が明らかに認められる。また、tenascinはradial gliaの突起上だけでなく、reeler mouseの小脳原基においては間質にも発現が認められた49)(図9)。
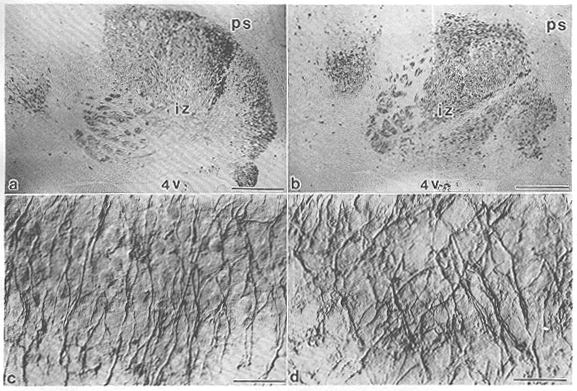
図9 胎生17日の正常およびリーラーマウスの小脳原基矢状断面における移動中のプルキンエ細胞の分布とtenascinの発現49)
a. 正常マウスおよびb. リーラーマウスの小脳原基の抗spot35抗体47)による免疫染色像。正常マウスにおいては、大部分のプルキンエ細胞は皮質に到達している。これに対し、リーラーマウスにおいては、大部分のプルキンエ細胞は集塊を形成してintermediate
zoneに停滞している。ps:軟膜表面、4V:第4脳室、iz:intermediate zone。図の右方が尾側、下方が腹側。scale
bar=200μm。c. 正常マウスおよびd. リーラーマウスの小脳原基intermediate
zoneの抗tenascin抗体による免疫染色像。正常マウスにおいては、免疫反応陽性のradial
gliaの突起が放射状に配列しているが、リーラーマウスにおいては、突起の配列が乱れ、交叉、束の異常形成像がが認められる。scale
bar=20μm
このような所見から、reeler mouseの小脳原基におけるプルキンエ細胞の移動障害には、radial gliaの形成異常によるcontact guidanceの障害とともに、gliaによるtenascin発現の異常も関わっていると考えられる。今後、reeler mouse小脳の発達過程におけるtenascinの分子種の発現の動態を遺伝子レベルおよびタンパク化学的に検討する必要がある。Edelmanのグループは、chickの小脳発生過程において、cytotactinのfibronectin type III repeatのdomainに対するcDNA probeを用いてin situ hybridizationを行い、脳室周囲のradil gliaの細胞体に遺伝子発現が局在することを明らかにしている35)。最近、マウスのtenascin遺伝子のクローニングが行われ、アミノ酸配列推定された。この結果から、chickのtenascinでみいだされていたfibronectin type III domainはマウスにおいても認められるが、chickではこのdomain内に存在した細胞接着活性部位のRGD sequenceがマウスでは認められないことがが明らかとなった45)。したがって、マウスのtenascinにおける細胞接着活性部位がどのアミノ酸配列部位に局在するのか、また移動細胞側における受容体は何かが今後の課題となろう。

小脳発生における神経回路形成過程で細胞接着因子の発現がどのように関与しているかを検討した研究はこれまであまりない。筆者らは、マウスの周生期における、脳幹の起始核から小脳皮質に投射する求心性線維の発達様式を調べ、この過程における細胞接着因子の発現を検討した。求心線維の発達過程を観察するため、灌流固定した胎生18日のマウス胎仔の脳幹腹側部にcarbocyanine系蛍光色素DiI15)を注入し、これをトレーサーとして脳幹より小脳原基へ投射する求心線維群を標識した。標識された求心線維束は小脳原基内に入ると次第に放散してゆき、その成長円錐は皮質に放射状に分布していた。同様の部位を、polysialic acid含量の高い胎児性NCAMを認識する抗NCAM-H抗体40)で免疫染色すると、この細胞接着因子は小脳原基内の求心線維束に強く発現していた(図10)。
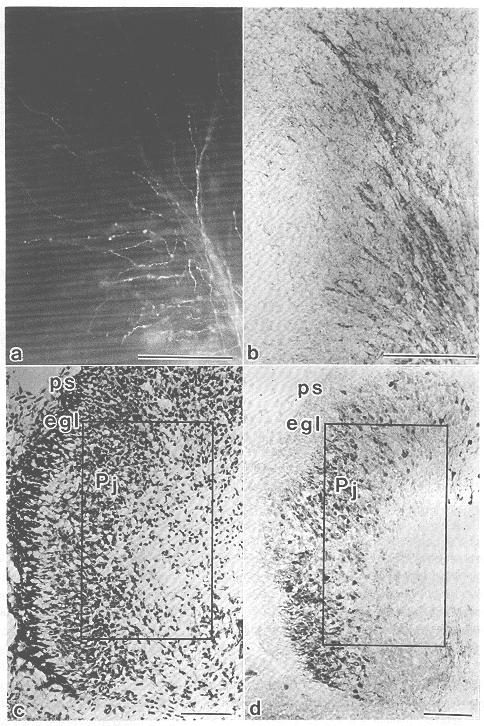
図10 胎生17日のマウス小脳原基横断面における求心性繊維の分布と細胞接因子NCAM-Hの発現
a. 脳幹腹側部へcarbocyanine系蛍光色素DiIを注入することにより、順向性に標識された15)求心性繊維の小脳原基内における分布。b.
aに隣接した切片の抗NCAM-H抗体40)による免疫染色像。DiIによって標識された求心線維束の分布に対応してNCAM-Hの発現が認められる。c.
隣接切片のNissl染色像。d. 隣接切片におけるspot35 47)免疫反応陽性プルキンエ細胞の分布。図c,dの枠内の領域が、それぞれ図a,bに対応する。ps:軟膜表面、egl:外顆粒層、Pj:プルキンエ細胞層。scale
bar=100μm
神経線維の伸長過程においては、成長円錐が標的を探索しつつ移動・放散するとともに、神経線維は相互に接着して束を形成し一定の方向性を保つ。この過程においては、移動する成長円錐と伸長経路の細胞外基質あるいは標的構造物との接着現象と、線維束形成における個々の線維間の接着現象が均衡を保っている。神経束の形成においては、線維間のhomophilicな結合が起こる。NCAM-Hは前述したようにhomophilicな接着に関与しており、成体型NCAMに比べて接着活性が低下していて、線維の伸長を阻害しない程度の線維間の接着性によって神経束の形態が維持されていると思われる37)。小脳原基において、求心性線維束から皮質内の個々の標的に向かって成長円錐が放散する過程では成長円錐の運動性が高まる必要性があり、このような部位では線維間の接着が抑制されると考えられる。小脳求心線維の発達過程におけるNCAM-Hの発現調節がタンパク部分の合成過程で行われているのか、あるいはpolysialic
acidの付加過程で行われているのかを、今後明らかにする必要がある。
求心性線維のうち登上線維は最初、標的のプルキンエ細胞の細胞体に幼若なシナプスを形成する。プルキンエ細胞の樹状突起が発達するに従い、登上線維の成長円錐はプルキンエ細胞上を細胞体から樹状突起に向かって移動し、最終的に樹状突起棘にシナプスを形成する26)。このシナプス形成が活発に起こる時期に対応して、免疫グロブリンスーパファミリーの一つであるThy-1がプルキンエ細胞の樹状突起ならびに細胞体に一過性に発現する30)(図11)。
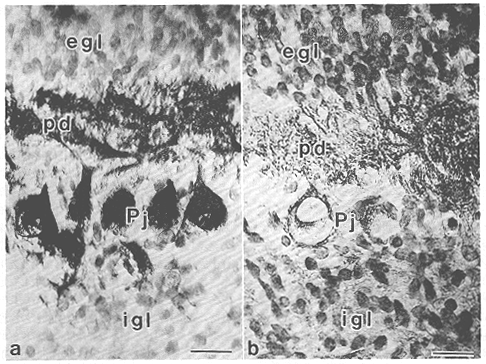
図11 生後11日のマウス小脳皮質矢状断面におけるThy-1の発現。
a. 抗spot35抗体47)による免疫染色像。プルキンエ細胞樹状突起(pd)の発達が認められる。b.
aの隣接切片の抗Thy-1抗体による免疫染色像。プルキンエ細胞の発達中の樹状突起(pd)ならびにプルキンエ細胞体(Pj)の膜構造にThy-1の発現が認められる。a,bともにDABにより免疫反応の発色を行い、cresyl
violetで対比染色した。egl:外顆粒層、igl:内顆粒層。scale bar=20μm
一方、プルキンエ細胞を標的とする登上線維には、プルキンエ細胞を標的とする登上線維には、プルキンエ細胞とシナプス形成が完了した後はじめてThy-1が発現する31)。Thy-1はNCAMの120kDの分子種と同様に、phosphatidylinositolを介して細胞膜に結合する膜タンパクであり、その一部はシナプス結合部位で細胞膜の裏打ちをする細胞骨格タンパクと強く結合している1,13)。さらに、Thy-1分子を介して膜流動性の変化やCa2+の細胞内へ流入38)など、細胞内への情報伝達に関連した現象が起こることも示されている。Thy-1分子自体に細胞接着活性は示されていないが、免疫グロブリンスーパーファミリーに属する細胞接着因子群との構造上の類似や、本分子に糖鎖が結合することにより分子構造の多様性が生じることをも合せ考えると、プルキンエ細胞と登上線維間のシナプス形成過程における細胞間相互作用に、Thy-1分子が関与していることが推測される。
成体になると、小脳分子層内のシナプス構造において特に後シナプス膜に局在して分子量180kDのNCAMが発現し、シナプス結合の安定化(stabilization)が起こる34)。齧歯類小脳の生後発達過程で、シンプス形成が活発な時期にはNMDA型のグルタミン酸受容体が一過性に発現するが14)、この時期に小脳内に持続的にNMDA受容体のantagonistを投与すると、正常なシナプスの形成と安定化の過程が阻害されることが報告されている36)。視覚伝導路の形成過程においても、シナプス形成後、NMDA受容体を介する刺激伝達活動が持続することによってシナプス結合が安定化されることが示されている8)。シナプス活動により、シナプス間隙の細胞外基質の変化が起こることが示されており、また、シナプスの安定化の過程で、接着因子、proteoglycanの産生が増加することも報告されている39)。さらに、発生過程の脊髄でNMDA受容体を刺激することにより、ニューロンによるproteoglycanの産生が誘導されることが形態学的に示されている21)。このような事実から、小脳発生過程で、NMDA受容体の刺激による細胞外基質、接着因子の産生誘導がシナプス形成と安定化の機序として関与する可能性が十分に考えられるが、今後、形態学的に検討する必要がある。

小脳の発生過程において細胞移動、神経回路形成に関わると考えられている上述の細胞接着因子は、培養細胞あるいはexplant cultureを用いたin vitroの実験系における、抗体を用いた活性阻害実験などから、接着活性の検証が行われてきた。さらに免疫組織化学あるいはin situ hybridization法により、in vivoの発生過程において、これらの因子の時間的および空間的な発現様式が明らかにされ、in vitroでの接着活性の意義づけが行われてきた。このような成果の蓄積によって、発生過程におけるこれらの因子の作用機序が解明される方向に大きく近づいている。今後は、発生過程の特定段階で、しかも特定の部位あるいは特定の細胞群においてこれらの因子を発現させ、あるいは発現を抑制して、どのような効果が生ずるかを形態学的に検証することが、これらの因子の機能の最終的な解明に必要であろう。このようなアプローチとして、細胞特異的に発現する遺伝子の転写制御エレメントに接着因子のcDNAあるいはantisense cDNAを結合して導入することによりtransgenic mouseを作製し、特定の部位あるいは細胞群において機能分子の遺伝子の発現を促進あるいは抑制することによって46)、その結果を解析することが重要となってくる。このような実験系の例として、インシュリン遺伝子のpromoterに神経成長因子NGFのcDNAを結合してtransgenic mouseを作製して、膵臓ランゲンハンス島のβ細胞で、NGFを異所性に発現させた実験がある。このtransgenic mouse においてはβ細胞に、正常では認められない高度の交感神経支配が誘導され、NGF のin vivoでの作用が実証されている12)。今後、このような実験系で、種々の細胞接着因子のin vivo での機能の究明、確認が行われることが期待される。

謝辞
抗NCAM-H抗体を御分与くださいました順天堂大学医学部解剖学教室の新井康允先生、石龍徳先生に感謝いたします。

1) Acton RT, Addis J, Carl GF, McClain LD, Bridgers WF:Association of Thy-1 differentiation alloantigen with synaptic complexes isolated from mouse brain. Proc Natl Acad Sci USA 75:3283-3287, 1978
2) Altman J, Bayer SA:Prenatal development of the cerebellar system in the rat. 1. Cytogenesis and histogenesis of the deep nuclei and the cortex of the cerebellum. J Comp Neurol 179:23-48, 1978
3) Bengmark S, Hugosson, R, Kallen B:Studien uber Kernanlagen im Mesencephalon sowie im Rostralteil des Rhombencephalon von Mus musculus. Zeitschr f Anat u Entwicklungsgesch 117:73-91, 1953
4) Book KJ, Morest DK:Migration of neuroblasts by perikaryal translocation:role of cellular elongation and axonal outgrowth in the acoustic nuclei of the chick embryo medulla. J Comp Neurol 297:55-76, 1990
5) Bretscher MS:How animal cells move. Scientific American 257(6):72-90, 1987
6) Chuong C-M, Crossin KL, Edelman GM:Sequential expression and defferential function of multiple adhesion molecules during the formation of cerebellar cortical layers. J Cell Biol 104:331-342, 1987
7) Chuong C-M:Differential roles of multiple adhesion molecules in cell migration:Granule cell migration in cerebellum. Experientia 46:892-899, 1990
8) Constantine-Paton M, Cline HT, Debski E:Patterned activity, synaptic convergence, and the NMDA receptor in developing visual pathways. Annu Rev Neurosci 13:129-154, 1990
9) Covault J:Molecular biology of cell adhesion in neural development. In Molecular neurobiology, ed by Glover DM and Hames BD, IRL Press, Oxford, 1989, pp 143-200
10) Edelman GM, Crossin KL:Cell adhesion molecules:implications for a molecular histology. Annu Rev Biochem 60:155-190, 1991
11) Edmondson JC, Liem RKH, Kuster JE, Hatten ME:Astrotactin:a novel neuronal cell surface antigen that mediates neuron astroglial interactions in cerebellar microcultures. J Cell Biol 106:505-517, 1988
12) Edwards RH, Rutter WJ, Hanahan D:Directed expression of NGF to pancreatic β cell in transgenic mice leads to selective hyperinnervation of the islets. Cell 58:161-170, 1989
13) French PW, Jeffrey PL:A population of Thy-1 molecules associated with the cytoskeleton. Neurosci Lett 75:107-112, 1987
14) Garthwaite G, Yamini Jr B, Garthwaite J:Selective loss of Purkinje and granule cell responsiveness to N-methyl-D-aspartate in rat cerebellum during development. Developmental Brain Res 36:288-292, 1987
15) Godement P, Vanselow J, Thanos S, Bonhoeffer F:A study in developing visual systems with a new method of staining neurons and their processes in fixed tissue. Development 101:697-713,1987
16) Grumet M, Hoffman S, Crossin KL, Edelman GM:Cytotactin, an extracellular matrix protein of neural and non-neural tissues that mediates glia-neuron interaction. Proc Natl Acad Sci USA 82:8075-8079, 1985
17) Hanaway J:Formation and differentiation of the external granular layer of the chick cerebellim. J Comp Neurol 131:1-14, 1967
18) Hatten ME, Mason CA:Mechanisms of glial-guided neuronal migration in vitro and in vivo. Experientia 46:907-916, 1990
19) Hausmann B, Mangold U, Sievers J, Berry M:Derivation of cerebellar Golgi neurons from the external granular layer:Evidence from explantation of external granule cells in vivo. J Comp Neurol 232:511-522, 1985
20) Hynes RO, Patel R, Miller RH:Migration of neuroblasts along preexisting axonal tracts during prenatal cerebellar development. J Neurosci 6:867-876, 1986
21) Kalb RG, Hockfield S:Induction of a neuronal proteoglycan by the NMDA receptor in the developing spinal cord. Science 250:294-296, 1990
22) Kawamura K, Nanami T, Kikuchi Y, Kitakami A: Grafted granule and purkinje cells can migrate into the mature cerebellum of normal adult rats. Exp Brain Res 70:477-484, 1988
23) Kawamura K, Yuasa S:Migration of Purkinje cells in the fetal mouse cerebellum. Abstracts of third IBRO world congress of neuroscience. P 44, 1991
24) Lander AD:Understanding the molecules of neural cell contacts:emerging patterns of structure and function. TINS 12:189-195, 1989
25) Lehmann S, Kuchler S, Theveniau M, Vincendon G, Zanetta J-P:An endogenous lectin and one of its neuronal glycoprotein ligands are involved in contact guidance of neuronal migration. Proc Natl Acad Sci USA 87:6455-6459, 1990
26) Mason CA, Christakos S, Catalano SM:Early climbing fiber interactions with Purkinje cells in the postnatal mouse cerebellum. J Comp Neurol 297:77-90, 1990
27) McGuire PG, Seeds NW:Degradation of underlying extra-cellular matrix by sensory neurons during neurite outgrowth. Neuron 4:633-642, 1990
28) Miale IL, Sidman RL:An autoradiographic analysis of histo-genesis in the mouse cerebellum. Exp Neurol 4:277-296, 1961
29) Moonen G, Grau-Wagemans MP, Selak I:Plasminogen activator-plasmin system and neuronal migration. Neture 298:753-755, 1982
30) Morris RJ, Beech JN, Barber PC, Raisman G:Early stages of purkinje cell maturation demonstrated by Thy-1 immunohistochemistry on postnatal rat cerebellum. J Neurocytol 14:427-452, 1985
31) Morris RJ, Beech JN, Barber PC, Raisman G Late emergence of Thy-1 on climbing fibers demonstrates a gradient of maturation from the fissures to the folial convexities in developing rat cerebellum. J Neurocytol 14:453-467, 1985
32) Ono K, Tokunaga A, Mizukawa K, Kurose K, Tanaka H:Abnormal expression of embryonic neural cell adhesion molecule(N-CAM)in the developing mouse cerebellum after neonatal administration of cytosine arabinoside. Developmental Brain Res 65:119-122, 1992
33) O'Shea KS, Rheinheimer JST, Dixit VM:Deposition and role of thrombospondin in the histogenesis of the cerebellar cortex. J Cell Biol 110:1275-1283, 1990
34) Persohn E, Pollerberg GE, Schachner M:Immunoelectron-microscopic localization of the 180kD component of the neural cell adhesion molecule N-CAM in postsynaptic membranes. J Comp Neurol 288:92-100, 1989
35) Prieto AL, Jones FS, Cunningham BA, Crossin KL, Edelman GM:Localization during development of alternatively spliced forms of cytotactin mRNA by in situ hybridization. J Cell Biol 111:685-698, 1990
36) Rabacchi SA, Bailly Y, Delhaye-Bouchaud N, Mariani J:Involvement of the N-methyl D-aspartate(NMDA)receptor in synapse elimination during cerebellar development. Science 256:1823-1825, 1992
37) Rutishauser U, Landmesser L:Polysialic acid on the surface of axons regulates patterns of normal and activity-dependent innervation. TINS 14:528-532, 1991
38) Saleh M, Lang RJ, Bartlett PF:Thy-1-mediated regulation of a low-threshold transient calcium current in cultured sensory neurons. Proc Natl Acad Sci USA 85:4543-4547, 1988
39) Schubert D:The possible roles of adhesion in synaptic modification. TINS 14:127-130, 1991
40) Seki T, Arai Y:Expressin of highly polysialylated NCAM in the neocortex and piriform cortex of the developing and the adult rat. Anat Embryol 184:395-401, 1991
41) Sievers J, Hartmann D, Gude S, Pehlemann FW, Berry M:Influences of meningeal cells on the development of the brain. In Mesenchymal-epithelial interactions in neural development, ed by Wolff JR, Siever J, Berry M, Springer-Verlag, Berlin Heidelberg, 1987, pp 171-188
42) Taber Pierce E:Histogenesis of the dorsal and ventral cochlear nuclei in the mouse. An autoradiographic study. J Comp Neurol 131:27-54, 1967
43) Trinkaus JP:Further thoughts on directional cell movement during morphogenesis. J Neurosci Res 13:1-19, 1985
44) Verrall S, Seeds NW:Characterization of 125I-tissue plasminogen activator binding to cerebellar granule neurons. J Cell Biol 109:265-271, 1989
45) Weller A, Beck S, Ekblom P:Amino acid sequence of mouse tenascin and deifferential expressin of two tenascin isoforms during embryogenesis. J Cell Biol 112:355-362, 1991
46) Westphal H, Gruss P:Molecular genetics of development studied in the transgenic mouse. Annu Rev Cell Biol 5:181-196, 1989
47) Yamakuni T, Usui H, Iwanaga T, Kondo T, Odani S, Takahashi Y:Isolation and immunohistochemical localization of a cerebellar protein. Neurosci Lett 45:235-240, 1984
48) Yuasa S, Kawamura K, Ono K, Yamakuni T, Takahashi Y:Development and migration of Purkinje cells in the mouse cerebellar primordium. Anat Embtyol 184:195-212, 1991
49) Yuasa S, Kawamura K, Kitoh J, Imaki J, Tsurushima H:Obstructed migration of Purkinje cells in the cerebellar primordium of reeler mouse. 神経組織の成長・再生・移植研究会・第6回学術集会論文集pp 104-105,1991

Abstract
Cell adhesion molecules in the development of the cerebellum
Shigeki Yuasa and Koki Kawamura
from
Department of Anatomy, school of Medicine, Keio University,
35 Shinano-machi, Shinjuku-ku, Tokyo 160, Japam.
A veriety of cell adhesion molecules play important roles in the processes of cell
migration, axonal elongation and synaptogenesis during the development of the central
nervous system. In this article, we review the mode of expression and the mechanism of
action of cell adhesion molecules occurring in the developing cerebellum. Significance of
the molecules in the formation of the cortical structure and the development of the neural
network are also discussed.
In the process of migration of granule cells from the external germinal layer into the
internal granular layer, migratory granule cells are guided by contact with processes of
Bergmann glia. The interaction between neurons and glia are mediated by many cell adhesion
molecule such as NCAM, NgCAM(L1), tenascin (cytotactin, J1), astrotactin, adhesion
molecule on glia(AMOG), thrombospondin or cerebellar soluble lectin(CSL).The neuronal
migration is facilitated by means of cycles of attachment and detachment between neurons
and glia. Tissue plasminogen activator is associated with the surface of migratory granule
cells and it facilitates the migration by degradation of adhesion molecules by proteolysis
through activation of the proteolytic enzyme.
Migration of Purkinje cells from the ventricular zone towards the cortex is mediated by
contact with radial glial processes. Tenascin, a neuron-glia adhesion molecule, is
expressed in these processes. Immature Purkinje cells transplanted in the adult rat
cerebellum migrate into the host tissue. Tenascin is shown to be expressed around the
ectopic Purkinje cells which have migrated from the grafted tissue. The findings strongly
suggest the participation of tenascin in the process of migration of Purkinje cells during
the development and regeneration.
During the development of the cerebellar afferent system, highly polysialilated
NCAM(NCAM-H) is expressed in the fascicles afferent fibers. The activity of homophilic
binding of this adhesion molecule is considered to participate in the fasciculation of the
growing axons.
Thy-1 molecule, a member of immunoglobulin superfamily such as NCAM or NgCAM, is also
expressed transiently on dendrites of Purkinje cells during the active period of
synaptogenesis with climbing fibers. In the adult rat cerebellum, NCAM bearing the
molecular expression may concern with the stabilization of synaptic junction in the
molecular layer. This molecular expression may concern with the stabilization of synaptic
junctions.
To substantiate the significance of these molecules in the neural development, the
examination of morphological changes due to the controlled expression of these adhesion
molecules in the transgenic animals is desired.
(Received:May 8, 1992)

神経進歩 36卷5号 1992年10月(医学書院)
許可を得て転載