
川野 仁・川村光毅
発生初期の脳には多数の遺伝子が部位および時期特異的に発現している。現在、それらの機能を知る目的で、特定の遺伝子を欠損させたノックアウトマウスが次々につくり出されている。そのような動物ではしばしば脳に著しい形態異常の起こることが報告されている。さらに、以前から知られていた脳の形態に異常のある突然変異動物でも、その原因が特定の遺伝子の欠損や変異にあることがわかってきた。このような脳の形態形成の異常を解析することにより、それぞれの遺伝子の機能的な役割と、脳の形成過程がしだいに明らかになりつつある。

はじめに
|
|||||||||||||
| おわりに | |||||||||||||
| 文献 |

すでに第1章で詳しく述べられているように、一連の脳の形成過程は厳密に定められた遺伝子プログラムに従って、正確に時期および部位特異的に進行する1)。ここ10年ほどの間に脳の形成に関係すると思われる遺伝子が次々にクローニングされ、それらの機能的意義が、構造的な特徴、発生過程での発現様式、あるいは培養系を用いた機能実験などから類推されている。さらに、実際の脳の形成過程における機能を知るため、それらの遺伝子を生体内で過剰発現や異所性発現、あるいは欠損させるような遺伝子操作を行った動物を作製し、そのような動物の脳に生じた変化を解析する方法が開発された。そのなかでも、とくに特定の遺伝子を欠損させたノックアウトマウスは脳の形成過程で劇的な異常の生じる例が多く、その異常を解析することにより、当該遺伝子の機能を特定し、さらには脳の形態形成の機序を明らかにすることができる。4-1節では突然変異や人為的な遺伝子欠損によっておもにマウスやラットの脳に生じた形態形成の異常と、その解析を通じて明らかにされつつある脳の形態形成過程の分子的機序について説明したい。

現在、特定の遺伝子を欠損させたノックアウトマウスは哺乳動物で遺伝子機能を知るための最も有効な方法の1つである2)。しかし、現在行われているジーンターゲティング法に問題がないわけではない。数多くのノックアウトマウスが作製されるにつれ、脳内できわめて重要な役割を果たしていると考えられている遺伝子を欠損させても何の変化もない、あるいはきわめて軽度な異常しか生じないという結果が頻繁にみられている。これは、構造と機能の類似した別の遺伝子が、欠損した遺伝子の機能を肩代わりするために起こった結果であると考えられている。このような例としては細胞外基質分子で、発生過程のニューロンの移動に関係するといわれてきたテネイシンや、脳内に広く発現する神経接着分子であるN-CAMなどが有名である3)。このほかにもジーンターゲティングでは、重要な遺伝子が欠損したことによって、胚性致死になる場合も多く、その後の解析ができなくなる。この問題をどう解決していくかが、ノックアウトマウスを用いた研究の大きなテーマである(後述)。
それに対して、いくつかの例ではほかに構造の類似した遺伝子が存在するにもかかわらず、ノックアウトマウスを作製すると、脳の形成に大きな異常の起こることが報告されている。それらのなかにはほかの遺伝子の発現を調節する転写調節因子をコードする遺伝子が多い。その理由として、①それぞれの遺伝子が発生初期の脳で部位特異的な発現をしているため、そのような部位では類似遺伝子による代償作用が働かないこと、②これらの転写調節因子はその下流に脳形成に関係する多数の標的遺伝子をもっており、そのノックアウトマウスは多数の遺伝子発現に影響を与えること、などが考えられている。
すでに第1章で説明されているように、脳の発生過程は階段的に起こるいくつかのステップを含んでいる。特定の遺伝子が欠損すると、この一連の事象の特定の段階がとくに影響を受ける。表1には4-1節で取り上げるノックアウトマウスと突然変異動物にみられる脳の形成異常をまとめてある。これはもちろん現在知られている異常のごく一部であることをあらかじめ知っておいてほしい。以下、順を追って、脳の形態形成の異常から明らかにされつつある脳形成のメカニズムについて説明していこう。
表I 4-1 節で扱う遺伝子欠損動物と脳の形成異常
| 形成過程 | 欠損遺伝子 |
発現部位 |
症状 |
文献 |
| 脳の形成 | Otx1 | 前脳、中脳 | 海馬と大脳皮質に軽度の形成不全 | 4 |
| Otx2 | 前脳、中脳 | 前脳と中脳の欠損 | 4 | |
| Lim-1 | 頭部中胚葉 | 前脳と中脳の欠損 | 4 | |
| 脳の領域化 | Emx1 | 終脳背側部 | 脳梁などの交差性線維の乱れ | 4 |
| Emx2 | 終脳背側部 | 海馬の形成不全など | 4 | |
| En1 | 中脳-後脳境界領域 | 中脳-後脳境界領域の欠損 | 5 | |
| En2 | 中脳-後脳境界領域 | 小脳形成異常 | 5 | |
| Wnt-1 | 中脳-後脳境界領域 | 中脳-後脳境界領域の欠損 | 5 | |
| Pax-6 | 前脳第1分節 | 前脳第1分節の中脳化 | 6 | |
| ニューロンの定着 | reelin | marginal zone | 大脳皮質、小脳などの層構造の異常 | 11 |
| 神経核の形成 | Brn-2 | 室傍核、視索上核 | 両核の欠損 | 12~14 |
| 神経路の形成 | reelin | marginal zone | 視床皮質路の皮質原基内での走行異常 | 15 |
| Pax-6 | 腹側視床 | 視床皮質路の腹側視床内での走行異常 | 発表準備中 |

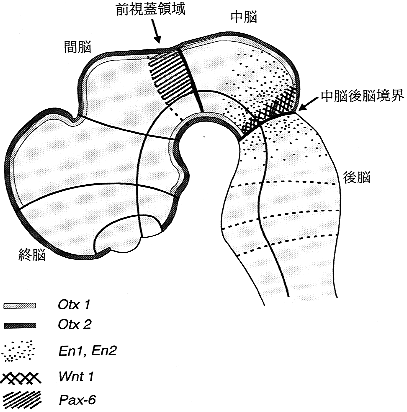
図1 脳の形成と領域化に冠する遺伝子の発現部位
胎生10日ころのマウス脳における各種遺伝子の発現を示す。otx1とotx2は前脳(終脳+間脳)から中脳にかけて、En1,En2、Wnt-1は中脳-後脳領域に、そしてPax-6は前視蓋領域に発現がみられる。
最近になって、脊椎動物の発生では、頭部の形成に体幹部とは異なる機序が存在することがわかってきた。脳にあてはめれば、その境界は中脳と後脳の間ということになる。実際、脳に発現する多くの遺伝子がこの境界領域に強く発現したり、境界の前後で異なった発現パターンを示すことが知られている(図1)。たとえばショウジョウバエのホメオボックス遺伝子であるotdの相同遺伝子Otx1とOtx2は神経管の吻側から生じた前脳から中脳にかけて発現する。そして、Otx2のノックアウトマウスは胎生9日前後で胚性致死になるが、この時点で、前脳と中脳はまったく形成されていない。
異常の生じた部分は発現部位と一致しておりOtx2が脳の形成に決定的な役割を果たす遺伝子(マスター遺伝子)の1つであると考えられる4)。一方、Otx2の類似遺伝子Otx1のノックアウトマウスではOtx2でみられたような脳形成の異常は観察されない。Otx1の発現領域はOtx2と完全に重複するため、Otx1の欠損をOtx2が機能的に補うと考えられる。実際、Otx1とOtx2の二重ヘテロ変異マウスでは両者の発現が重複している間脳視床上部と背側視床、中脳背側の視蓋などに重篤な形成不全が認められた。これらのことから、Otx1とOtx2の両者がともに脳の形成に共同して働くことを示している。
なお、頭部中胚葉に発現する転写調節因子であるLim-1のノックアウトマウスでも、Otx2ホモ変異マウスとほぼ同じ異常が起こることが知られている。頭部中胚葉からのシグナルが頭部神経上皮のOtx2の発現に必要であることが示されており、脳の形成には頭部の中外胚葉の相互関係が重要であることがわかってきた。

発生初期の脳は成熟したものとはまったく異なった構造をしている。そのような脳の原基は第1章1-2節でも述べられたように、長軸方向に沿った数多くの分節構造からなっていることが種々の遺伝子発現パターンの解析からわかってきた。このような発生初期の脳に領域特異的に発現する遺伝子が欠損した場合には、しばしば特定の脳領域が欠損したり、その性質が変化したりする。たとえばあとで述べる転写調節因子Pax-6は前脳の第1分節(prosomere1:前視蓋領域)に発現がみられる(図1)が、Pax-6の欠損マウスではこの部分が中脳化してしまう6)。さらに、大脳皮質でもEmx1とEmx2がその領域化に関係することが最近わかってきた。両遺伝子はいずれも終脳に発現がみられるが、Emx1の発現領域はEmx2より狭く、とくに大脳皮質内側部の将来海馬体や歯状回になる部分にはEmx2だけが発現している。この発現パターンを反映するように、Emx2のノックアウトマウスでは海馬領域の形成が不全である。一方、Emx1とEmx2の両方の遺伝子の発現が重複している大脳新皮質ではほとんど異常はない。これらの結果は、Emx1とEmx2が終脳の領域化、すなわち海馬と大脳新皮質の違いを決定している可能性がある。
また、ショウジョウバエのengrailedのマウス相同遺伝子であるEn1、En2はホメオドメインをもつ転写因子をコードする遺伝子であるが、En1のノックアウトマウスでは中脳と後脳の第1分節が完全に消失する。En1もEn2も発生初期に中脳-後脳境界領域に発現する(図1)が、一方のEn2の欠損マウスではEn1に比べてごく軽度な異常しかみられなかった。しかしながら、この違いは両遺伝子の機能的な相違によるものではなく、En1のほうが発生過程でより早く発現することによるらしい。実際、En1を欠損させ、その代わりにEn2を発現させると、En1欠損による脳の形成異常が現れない7)。この結果はEn2がEn1の機能を代償できることを示している。さらに中脳-後脳領域に発現する分泌性タンパク質であるWnt-1の遺伝子ノックアウトマウスでもEn1と同様な中脳-後脳領域の欠損がみられる。興味深いのはWnt-1はEn1、En2の発現を支配していると考えられることで、遺伝子発現を調節する機能をもつ転写調節因子自体の発現がさらに分泌性因子によって調節されることを示している8)。

第1章 1-5節ですでに述べられているように、発生初期の脳では脳室に面した神経上皮層で莫大な数のニューロンが生み出され、それぞれの最終定着部位へと移動する。この移動様式は脳の部位によって異なり、その結果、それぞれの部位で特有の神経組織構築がつくられることになる。脳のニューロンの配列にはいくつかのパターンがあるが、なかでも嗅球、大脳新皮質、海馬、中脳視蓋、小脳などでは、同じ性質のニューロンが層状に整然と配列する。ニューロンの配列が乱れるような突然変異マウスが以前より知られていた。リーラー(千鳥足)マウスとよばれる突然変異マウスは種々の運動機能障害を示すが、ホモ変異マウスの脳を調べてみると、大脳皮質や小脳などの層形成が異常であることがわかった。最近になって、リーラーマウスで欠損する遺伝子が明らかにされ、reelinと名づけられた。
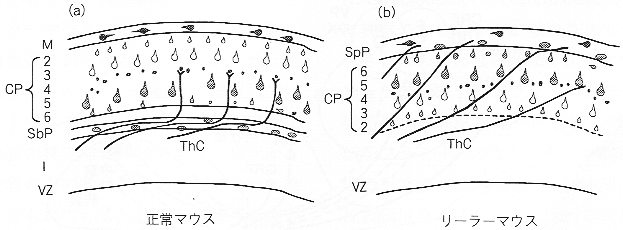
図2 正常マウス(a)とリーラー突然変異マウス(b)における大脳皮質の神経構築と神経路
正常マウスでは皮質のニューロンは表層から辺縁層(M)、皮質板(CP)の2~6層、サブプレート(SbP)の順に配列する。リーラーマウスでは辺縁層とサブプレートが分かれず、スーパープレート(SpP)として表層にとどまる。その結果、皮質板の層構造は逆転し、さらに、正常マウスではサブプレートに沿って走行する視床皮質路の軸索(ThC)は皮質板を斜めに横切り、スーパープレートまで達してします。
哺乳類の大脳新皮質は形態と機能の異なったニューロンが6層に配列している。発生過程では、側脳室に面した神経上皮層で最終分裂を終えた幼若なニューロンが順次脳の表層に移動して層を形成する(図2)。最初に誕生したニューロンは脳の表層にまで移動してプレプレート(preplate)を形成する。その後、皮質の6層から2層のニュ-ロンが表層に移動して皮質板(cortical plate)を形成する過程で、プレプレートのニューロンは2群に分かれ、脳表面の辺縁層(marginal zone)と皮質板の直下のサブプレート(subplate)に分かれる。ここで特徴的なのは、皮質板のニューロンは6層のものが最初に生まれ、まず辺縁層の直下に定着するが、その後に生まれた5層、4層のニューロンは先に移動したニューロンを追い越して、より表層に定着する。このように、あとに移動したニューロンほど表層に定着するような組織構築過程をinside-outパターンという10)。
リーラー突然変異マウスでは、正常マウスとは異なり、皮質板を構成する最初の第6層のニューロンが表層に移動しても、プレプレートは2つに分かれず、さらに次に生じた5層のニューロンは6層のニューロンを追い越さず、その直下にとどまってしまう。つまり、大脳皮質神経構築に必要なinside-outパターンの配列」はみられず、先に生まれたニューロンがより表層に位置する。Outside-inの配列になってしまう(図2)。原因遺伝子であるreelinがコードするタンパク質であるreelinは分子量400Kに達する分泌性タンパク質である。reelinは正常マウスの大脳皮質の形成過程では最初に形成されるプレプレートに、ついでそこから分かれてできるmarginal zoneに発現する。これらのことから、大脳皮質の最外層に存在するreelinは移動してくるニューロンに対し親和性をもち、新しく移動してくるニューロンの移動、定着に関係すると推察されている11)。

脳のニューロンは上に述べたように層を形成するほかに、一般に神経核(nucleus)とよばれる均一な細胞集塊を形成する。このような神経核は視床から延髄に至る脳幹に多くみられる。神経核のニューロンは通常同一の起源をもち、その形状、性質、軸索投射、機能などが共通する場合が多いが、さらにいくつかの亜核(subnuclei)に分かれたり、異なる性質のニューロンが混合する場合も多い。いくつかの遺伝子はその発現が特定の神経核に限られており、それらは、特定の神経核の発生に深く関係すると考えられる。実際、これらの遺伝子をノックアウトすると、しばしば特定の神経核が欠損する。
POU転写調節因子群の遺伝子は脳の発生過程で最初は脳の「領域」に一致して発現するが、発生が進むとともに、特定の「ニューロン集団」に発現するようになる。たとえばOct-2は視床下部の視交叉上核、Brn-3は延髄の下オリーブ核といったように。そのなかで、Brn-2は視床下部の神経分泌核である室傍核(PVN)と視索上核(SON)に特異的に発現することが知られている。Brn-2のノックアウトマウスではこの両核に細胞体をもち、下垂体後葉に投射する大型神経分泌ニューロン(magnocellular neurosecretory neurons)が欠損するため、後葉ホルモンであるバソプレッシンとオキシトシンが消失する。さらに、PVNの小細胞区に細胞体をもつCRFニューロンも消失する。これらのニューロンの存在部位はBrn-2の発現部位と重なることから、Brn-2の欠損が直接ニューロンの生存に影響を与えたと考えられた。ただし、同じくPVNの小細胞区に存在するTRHニューロンと前室周囲部に存在するソマトスタチンニューロンに関しては、細胞体は存在する12)が、それぞれの神経終末は正中隆起外層から消失する13)ため、これらのニューロンでは線維投射にのみ異常があるかもしれない(図3)。
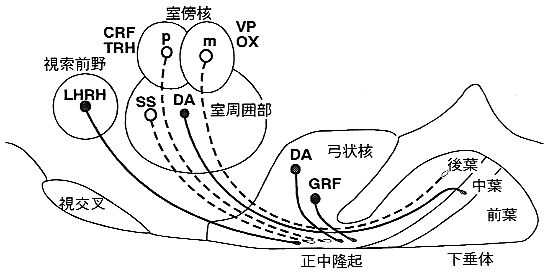
図3 Brn-2ノックアウトマウスにみられた視床下部神経分泌ニューロンの異常
Brn-2欠損マウスではBrn-2が発現する室傍核のニューロンに異常が起こる(点線)。室傍核の大細胞区(m)のバソプレッシン(VP)とオキシトシン(OX)ニューロン、室傍核の小細胞区(p)のCRFニューロンは消失し、TRHニューロンと室周囲部のソマトスタチンニューロンは細胞体は存在するが、正中隆起の線維終末は消失する。
Brn-2は脳の発生過程の初期からすでに神経管に広く発現している。視床下部の神経分泌ニューロンは第3脳室に面した神経上皮層で最終分裂を終え、外側へ移動してそれぞれの最終部位に定着する。Brn-2を欠損したマウスでも、少なくとも後葉系ニューロンは神経上皮で生まれ途中まで移動する。しかし、SONに到着する前に消失してしまう。後葉系ニューロンにはBrn-2が発生の最初期から成体まで継続して発現する。Brn-2は神経ペプチドであるCRFのプロモーターに結合するという報告もあり、Brn-2は視床下部神経分泌ニューロンの基本的な機能を発生過程全体を通じて調節していると思われる14)。

脳の神経路形成のメカニズムは非常に複雑であるが、最近の研究により各種の神経接着分子、細胞外基質分子、神経成長因子、分泌性因子、膜タンパク質などが関係することがわかってきた。その特徴は神経路によってその形成メカニズムがそれぞれ異なっていることである。これまでのところ、特定の遺伝子を欠損させることによって、特定の神経路に異常がみられる例は多くない。脳の神経路が形成される時期はこれまで述べてきた発生過程に比べて遅いので、神経路の形成時期より以前の段階で脳に大きな障害が起こると、多くの場合、神経路形成のメカニズムの解析が不能になってしまうこともその一因であろう。
前述のリーラーマウスでは、大脳皮質、小脳、海馬などの層構造に異常がみられるほか、神経路にも異常のあることがわかっている。哺乳類では嗅覚を含めてすべての感覚は視床でニューロンを換え、大脳皮質の特定領域に投射する。視床からの線維は、皮質のどの領域でも第4層で分枝し終末することが知られている。視床皮質路の形成過程を観察すると、マウスでは視床からの軸索は胎生14日に大脳皮質原基に外側部から進入するが、この時期は将来第6層を形成するニューロンが定着したばかりで、まだ第4層のニューロンは移動定着していない。皮質原基に進入した視床からの軸索は皮質板直下に発生過程で一過性に存在するサブプレートに沿って伸長し、サブプレートのニューロンと一過性のシナプスを形成し、第4層のニューロンが移動したあとに皮質板内に進入する。リーラー突然変異マウスでは視床からの軸索が大脳皮質に進入するところまでは正常であるが、その後、皮質板の直下を伸長せず、皮質板内部を斜めに表層まで伸長してしまう15)。リーラーマウスにおけるこのような神経路形成異常の機序はreelinの欠損が直接関係するものではないらしい。むしろ、視床からの軸索が親和性をもつサブプレートのニューロンが皮質板直下に存在せず、辺縁層のニューロンとともに大脳皮質の表層にとどまってしまったためと考えられる(図2)。
また、Pax転写調節因子群に属するPax-6を欠損する動物では、種々の神経路形成に異常がみられる。Pax-6は目の形成に重要な役割をもつ遺伝子で、その相同遺伝子はショウジョウバエ、ゼブラフィッシュ、マウス、ラット、ヒトでいずれも目の形成に関係する。Pax-6を欠損する突然変異マウスとラットは、ホモ接合体が出生とともに死亡し、ヘテロ接合体では目の形成が未熟であるため、それぞれ小眼球マウス、小眼球ラットとよばれている。小眼球マウスでは前述のように前脳の第1分節が消失してしまう。これに伴って、tract of postoptic commissure(TPOC)の走行に異常の生じることが報告されている。
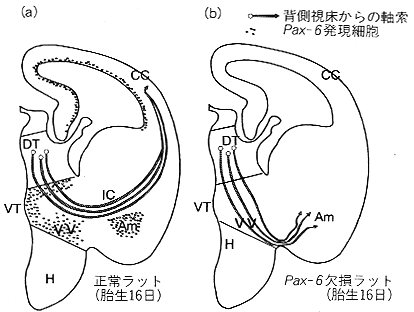
図4 正常SDラット(左)とPax-6欠損ラット(右)における背側視床からの軸索走行経路
正常ラットでは視床からの軸索は腹側視床(VT)の外側部で神経束を形成し、内包(IC)を経由して大脳皮質原基に進入し、腹側視床の腹側部(VV)と扁桃体(Am)のPax-6発現細胞群には進入しない。これに対してPax-6欠損ラットでは、同じ軸索は正常ラットでは避けるはずの部位(VV,Am)に進入し、皮質原基に到達しない。CC:大脳皮質、DT:背側視床、H:視床下部。
さらにわれわれは、Pax-6を欠損する突然変異ラットである小眼球ラットの大脳皮質において神経路形成の異常を見いだした。Pax-6はPax遺伝子ファミリーのなかで唯一前脳に発現し、胎生期の正常脳では、嗅球、大脳皮質、腹側視床、前視蓋領域などに発現し、Pax-6欠損ラットの脳ではそれらの部位に一致してさまざまな形成異常が観察される。このような動物で、大脳皮質の神経路の中で視床皮質路の走行に異常があることがわかった。しかし、前に述べたリーラーマウスの場合、視床皮質路の線維路は皮質原基の中で走行異常を示すのに対し、小眼球ラットでは、背側視床の軸索は皮質原基に達するはるか以前に腹側視床の中で異常を示した。正常ラット胎仔では背側視床からの軸索は腹側視床の外側で神経束をつくり、線条体の内部で内包を形成してから、皮質原基に進入する。これに対して、小眼球ラットでは、背側視床の軸索は正常と同じように腹側視床まで伸長しても、腹側視床の外側部で神経束をつくることなく、脳底部まで達してしまい、皮質原基には進入できなかった。(図4)。Pax-6は腹側視床で背側と腹側の2つの部分に分かれて発現し、背側視床からの軸索は背側のPax-6発現部位は通過するが、腹側の部分は避けるように進む。小眼球ラットでは腹側のPax-6が発現するはずの部分に背側視床からの軸索が進入してしまうため、神経路の異常が生じると考えられる。同様に内包のレベルでも、正常胎仔では扁桃体のPax-6発現部位を避けて走行するが、小眼球ラットではこの部位にも背側視床からの軸索が迷入している。以上のことから、腹側視床と扁桃体に存在するPax-6はおそらく視床からの軸索を反発するような分子の遺伝子発現を調節していると考えられた。以上のように、遺伝子欠損の結果みられる神経形成異常はその解析がむずかしく、脳内の神経回路が実に巧妙な仕組みで形成されることを示唆している。

最近までまったくわかっていなかった脳の形態形成の機序が分子・遺伝子レベルで説明できるようになってきた。ここで取り上げたノックアウトマウスをはじめとして脳の形態異常を人工的につくり出せるようになったことは大きな驚きであり、しかもそれが単一の遺伝子を操作することによって生じることは以前にはほとんど信じがたいことであった。もちろん、脳の形態形成のメカニズムはきわめて複雑で、本節で紹介した実験結果は、全体からみれば森の入り口の小径程度の指針にしかあたらないかもしれない。しかし、将来的により多くの知見が得られることはまず間違いがない。現在、発生過程の特定の時期に特定の部位で起こる形態形成過程の機序を調べるための時期および部位特異的ないわゆるコンディショナル遺伝子ターゲティング16)の手法の確立が切に望まれている。そのような技術的な改善が進むとともに脳の形態形成の機序の理解がさらに深まっていくだろう。

1) 八田公平:蛋白質 核酸 酵素、40、709-714(1995)
2) 八木 健:蛋白質 核酸 酵素、40、599-608(1995)
3) 小野勝彦:蛋白質 核酸 酵素、40、2188-2196(1995)
4) 松尾 勲・吉田道生・須田容子:細胞工学、16、400-407(1997)
5) 有賀 純:実験医学、15、440-445(1997)
6) Mastick, G. S., Davis, N. M., Andrews, G. L., Easter, S. S. Jr.: Development, 124,
1985-1997(1997)
7) Hanks, M., Wurst, W., Anson-Cartwright, L., Auerbach, A. B., Joyner, A. L.: Science,
269, 679-682(1995)
8) McMahon, A. P., Joyner, A. L., Bradly, A., McMahon, J. A.: Cell, 69, 581-595(1992)
9) D'Areangelo, G., Miao, G. G., Chen, S.-H., Soares, H. D., Morgan, J. I., Curran, T.:
Nature, 374, 719-723(1995)
10) 永田 功・中辻憲夫:蛋白質 核酸 酵素、40、755-767(1995)
11) 小川正晴:蛋白質 核酸 酵素、42、577-583(1995)
12) Schonemann, M. D., Ryan, A. K., McEvilly, R. J., O'Connell, S. M., Arias, C.
A.,Kalla, K. A., Li, P., Sawchenko, P. E., Rosenfeld, M. G.: Genes Dev., 9, 3122-3135
(1995)
13) Nakai, S., Kawano, H., Yudate, T., Nishi, M., Kuno, J., Nagata, A., Jishage, K.,
Hamada, H., Fujii, H., Kawamura, K., Shiba, K., Noda, T.: Genes Dev., 9, 3109-3121(1995)
14) 川野 仁・中井茂康・川村光毅・野田哲生:神経研究の進歩、39、785-800(1995)
15) Yuasa, S., Kitoh, J., Kawamura,K.: Anat. Embryol., 190, 137-154(1994)
16) 丸山光生:実験医学、15、2107-2113(1997)

脳と神経 分子神経生物科学入門(金子章道、川村光毅、植村慶一編、共立出版会社、1999発行)
308頁―315頁より許可を得て転載