
視床下部神経分泌ニューロンの発生過程とPOU転写調節因子
(Development of mouse hypothalamic neurosecretory neurons and Brn-2, a POU transcription factor)
川野仁、中井茂康、川村光毅、野田哲生

| はじめに | |
| I. POU転写調節因子 | |
| II. Brn-2欠損マウス | |
| III. 視床下部の神経分泌ニューロンとBrn-2 | |
| IV. 視床下部神経分泌ニューロンの発生過程 | |
| V. 後葉系ニューロンの初期発生とPOU転写調節因子 | |
| おわりに | |
| 文献 | |
| Abstract |

生体でみられるさまざまな形態形成過程のうちでも、一見単純な構造の神経管が、複雑な組織構築を持つ脳へと変貌する過程には誰しも興味をそそられるだろう。しかしながら、脳の莫大な数のニユーロンが織りなす緻密な神経ネットワークが発生過程を通じてどのようなメカニズムによって形成されるかは、長い間の謎であった。最近になってようやく、分子、遺伝子レベルの研究の積み重ねのおかげで、この生物学の聖域とでもいうべきテーマを実験的に取り扱うことが可能になってきた。とくに近年、脳の形成に関与すると考えられる新しい遺伝子が次々にクローニングされ、この分野の研究はこれまでにない盛況を呈しているが、このテーマの難しさはむしろ、脳の神経構築とその形成過程が他の臓器にはみられないほど、部位による多様性に富んでいることに起因すると思われる。ニューロンとグリアの分化、細胞の移動、神経突起伸長、シナプス形成など一連の脳の発生過程には、脳全体に共通するものと、それぞれの部位に特異的なものがあるが、後者による神経構築過程は、将来現れてくる脳の機能の部位特異性とも関連して、興味深いものがある。
これまでに、発生初期の中枢神経系内において、部位特異的な発現を示す遺伝子が数多く見出されている。これらの遺伝子産物は各種の転写因子、接着因子、成長因子、受容体など多種多様であるが、それぞれの部位の特異的な発生過程に関与している可能性がある。したがって、これらの分子が脳の各部位の神経構築過程にどのような役割を果たしているかを明らかにすることは、脳の形態形成の機序の解明から、ひいては脳の機能発達の仕組みを知る上でも重要な研究課題となるだろう。
本稿では、そのような部位特異的な発現を示す遺伝子の中でもとくに注目されるPOU転写因子の一つ、Brn-2に焦点を当て、脳内でも特異な機能と性質をもつ、視床下部神経分泌ニューロン、とくに下垂体後葉に投射するニューロンの発生過程との関わりについて、現在まで得られている知見を紹介する。

最近、中枢神経系内に特異的に発現する遺伝子が次々にクローニングされている。それらの中でも発生初期に発現する各種の転写調節因子群は脳の形態形成をあやつる遺伝子として注目を集めている。これらの多くのものは発生過程の中枢神経系でそれぞれ特異的な発現様式を示すことが知られている。たとえば、脊髄から後脳のレベルまで発現するHox遺伝子群や脳全体を区分する分節(neuromere)に一致して発現するWntおよびPax遺伝子群などは脳の前後軸や脳領域の決定に重要であると考えられている28)。一方、LIM遺伝子群39)やPOU遺伝子群38)に属する多くの遺伝子は特定の神経核やニューロン群に限局して発現がみられることから、神経核の形成やニューロンのphenotypeの決定に関係が深いと思われる。
とりわけ、興味深いのはPOU遺伝子群に属する遺伝子であり、それぞれのメンバーが生体内、とくに脳内で特異的な発現パターンを示すことが知られている。POU遺伝子群の転写産物はその配列中にきわめて保存性の高いPOUドメインを含んでいる。このPOUドメインは約150個のアミノ酸残基からなり、ホメオティック遺伝子のホメオボックスと高い相同性を示すPOU homeodomainと、POUドメイン蛋白に特異的なPOU specific domainの二つの部分に分けられる。両ドメインはいずれもDNA結合活性をもち、オクタマーモチーフ(ATGCAAAT)をはじめとして31)、特徴的なDNA配列に結合する41)ことから、この蛋白は転写調節因子として働くとみなされている。POUドメイン遺伝子は次々にクローニングが続けられ、現時点で15種以上の遺伝子が明らかにされ、構造の類似性により、6つのサブグループに分けられている(表1)が、そのメンバーは現在も増え続けている。
POUドメイン遺伝子の中で、class IIIと呼ばれるグループに属する遺伝子として現在まで4種のもの(Brn-1, Brn-2, Brn-4, Tst-1)が知られているが、これらの発現は発生初期には、脳室に面した神経上皮にみられ、成熟するにつれて特定の部位や神経核に移行することが知られている13)。成体での発現部位には、小脳、海馬、大脳皮質のような層構造を示す部位もあれば、室傍核、視交叉上核、下オリーブ核のようなコンパクトな神経核もある(表1)。それらのPOUドメイン蛋白の機能についてはまだ研究が始まったばかりの段階ではあるが、成熟動物における遺伝子発現部位と、ゲルシフト法やフットプリント法により明らかにされた転写産物のプロモーター結合能から考えると、それぞれが特定の細胞で、特定の遺伝子発現を調節していると考えられている。すなわち、Brn-2は視床下部のニューロンに含まれる神経ペプチドであるcorticotropin-releasing factor(CRF)を24)、またTst-1は末梢のグリア細胞であるSchwann細胞に発現する、Igスーパーファミリーに属する接着因子Poを14)、そして、Pit-1は下垂体前葉細胞で合成される成長ホルモン(GH)とプロラクチン(PRL)を15)、それぞれ標的遺伝子とすることが報告されている。もちろん、既知のPOU転写因子の標的遺伝子が限られている現段階では、POU転写因子の発現があっても、その機能の推察されない部位の方が多いのはいうまでもない。
POU転写調節因子の発生初期における機能についても、これまでにいくつかの知見が得られている。POU転写調節因子群の中でも、とくにPit-1に関しては発生初期の細胞分化に重要な働きを持つことが知られている。下垂体性の矯小マウスであるSnell dwarf mouseではPit-1遺伝子に点変異のあることが知られており、この動物では下垂体前葉にGH,PRL、甲状腺刺激ホルモン(TSH)を産生する細胞が存在しない。Pit-1は下垂体前葉ホルモン産生細胞の分化の直前に上述の前葉細胞にのみ発現すること、および、Pit-1蛋白がGHやPRLの遺伝子プロモーターに直接結合することを考えると、Pit-1は下垂体前葉細胞の分化に直接関係すると思われる40)。また、線虫のPOUドメイン蛋白であるUnc-86は発生初期に特定のニューロンの前駆細胞に発現する。Unc-86を欠損したミュータントではその前駆細胞から分化するニューロンが出現しないことから、Unc-86は特定のニューロンの分化に関係すると考えられている8)。前述のように齧歯類の脳内でも、発生初期にはClass IIIに属するPOU遺伝子群が、脳室に面した神経上皮層に発現しており13)(表1)、この部位では、未分化な細胞が分裂を繰り返し、ニューロンとグリアを生み出しているので、これらの遺伝子が脳においても細胞の分化を調節している可能性は大いに考えられる。

以上述べてきたように、POUドメイン蛋白群は発生分化と神経機能の両方に直接関係する転写調節因子として、脳内で重要な働きをしていると推測される。それらの機能を明らかにするための、もっとも有効な方法は現在のところ、相同組み換えにより、特定の遺伝子をノックアウトし、作成した遺伝子欠損動物を解析することである。
表1 哺乳類におけるおもなPOU転写因子の特徴(文献4,13を改変)
POUドメイン |
サブクラス | 発現(発生初期) | 発現(胎生後期~成体 |
標的遺伝子 | |
神経系 |
非神経系 |
||||
| Pit-1 | I | 神経上皮 下垂体前葉 |
なし | 下垂体前葉 | 成長ホルモン プロラクチン |
| Oct-2 | II | 神経上皮 | 視交叉上核 内側乳頭体核 小脳顆粒細胞 |
リンパ節、腸管 腎臓、精巣 |
|
| Brn-2 | III | 神経上皮 | 室傍核、大脳皮質 小脳プルキンエ細胞 |
なし | CRF |
| Tst-1 | III | 胚性幹細胞 神経上皮 |
海馬、小脳顆粒細胞 Schwann細胞 |
精巣 | Po |
| Brn-3.0 | VI | 神経上皮、網膜 知覚神経節 |
知覚神経節、手綱核 下オリーブ核、迷走神経核 |
脾臓 | |
| Oct-3/4 | V | 胚性幹細胞 原始生殖細胞 |
なし | 卵細胞 | |
| Brn-5 | VI | 神経上皮 | 大脳皮質、小脳、延髄 | 精巣、下垂体前葉 腎臓、骨格筋 |
|
POU転写因子の中でも、class IIIに属するBrn-1 13)、Brn-2(表1)、Brn-4 25)の三つの転写因子は成体ラットの間脳視床下部では室傍核と視索上核という神経分泌核に特異的な発現がみられる。とくにBrn-2は前述のように室傍核のニューロンに含まれるCRFのプロモーターを活性化することがわかっている。このことは、Brn-2が視床下部の特定のニューロンの機能の維持に働く可能性を示している。そこで、私たちはBrn-2の機能を知る目的で、遺伝子の相同組み換えによりBrn-2を欠損させ、そのマウスの脳にどのような変化が生じるかについて解析を行った。
Brn-2欠損マウスは、マウス胚性幹細胞のBrn-2遺伝子を機能不全型遺伝子と置き換え、胞胚中に注入し、作成したキメラマウスを交配する、いわゆる相同組み換えによる遺伝子ノックアウト12)によって得た。
Brn-2を欠損したホモ接合体マウスはすべて出生後数日以内に死亡した。組織学的所見からは末梢組織にはとくに異常は認められなかった。Brn-2の発現は発生過程を通じて中枢神経系に限局している(表1)ことから、出生後の死因は中枢神経系の異常によるものと思われた。そこで、出生後のホモ接合体マウスの脳の切片をニッスル染色して観察した。しかし、Brn-2の発現が報告されている大脳皮質、小脳などを始めとして、脳のほとんどの部位の構造には野生型マウスと大きく異なる点はみられなかった。ホモ接合体マウスの脳では唯一、間脳視床下部に異常が認められた。パラフィン切片のニッスル染色標本で観察すると、視床下部ではBrn-2が特異的に発現する室傍核と視索上核の神経細胞体が欠失していたのに加え、正中隆起部と下垂体後葉の著しい萎縮が明瞭に認められた(図1)。このことから、Brn-2欠損マウスでは視床下部の神経内分泌系に特異的な異常のあることが示唆された。
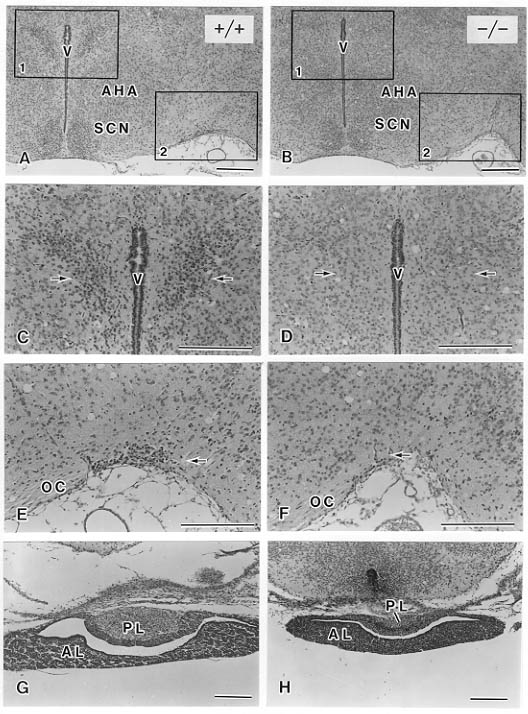
図1 Brn-2欠損マウスの野性型(+/+, A)とホモ結合体(-/-, B)における前部視床下部パラフィン切片のニッスル染色像。生後4日。AHA:前視床下野,SCN:視交叉上核,V:第三脳室。C,D:四角枠1(A,B)の拡大。室傍核の細胞集塊(C,矢印)はホモ結合体では消失している(D,矢印)。E,F:四角枠2(A,B)の拡大。視索上核の細胞集塊(E、矢印)はホモ結合体では消失している(F,矢印)。OC:視交叉。G,H:下垂体のニッスル染色像。野性型(G)でみられる下垂体効用(PL)はホモ結合体(H)では著しく萎縮している。AL:下垂体前葉。スケールバーは200μm。

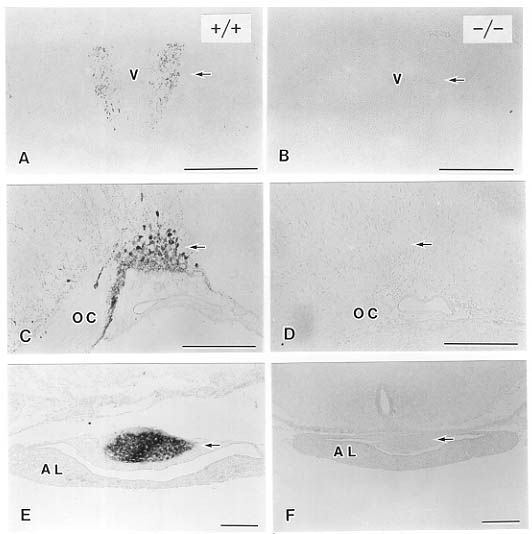
図2 Brn-2欠損マウスにおけるバソプレッシン免疫陽性反応。生後4日。野性型(+/+)でみられる室傍核(A)と視索上核(C)の陽性細胞体(矢印)と下垂体後葉(E)と陽性線維終末(矢印)はホモ接合体(-/-)では認められない(B,D,F,矢印)。AL:下垂体前葉,OC:視交叉、V:第三脳室。スケールバーは200μm。
これまでの研究により、視床下部の神経内分泌系には数々の神経ペプチドや伝達物質の含まれていることがわかっている36)。そこで、脳の凍結切片を用いて各種神経ペプチドあるいは神経伝達物質の合成酵素の局在を免疫組織化学的に調べると、ホモ接合体マウスでは室傍核と視索上核のバソプレッシン含有細胞体、および、下垂体後葉のバソプレッシン線維終末が消失していた(図2)。さらには、正常動物で正中隆起外層に存在するCRF, thyrotropin-releasing hormone(TRH)、ソマトスタチンをそれぞれ含む神経線維終末もBrn-2欠損動物では認められなかった(図3)。それに反し、正中隆起外層のカテコールアミンの合成酵素であるtyrosine hydroxylase(TH)、あるいはluteinizing hormone-releasing hormone(LHRH)を含む線維終末はBrn-2欠損動物でも消失していなかった(図4)。
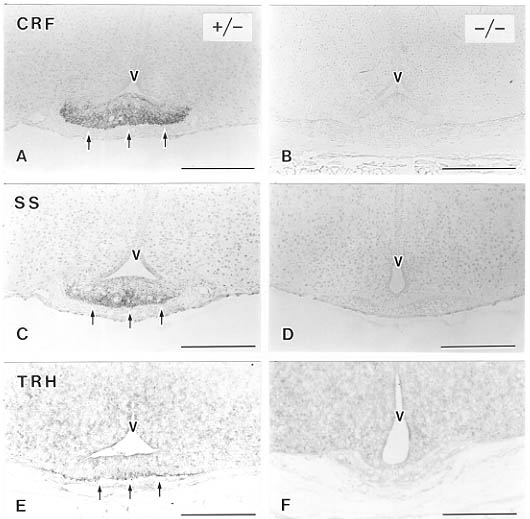
図3 Brn-2欠損マウスの正中隆起におけるCRF(A,B),ソマトスタチン(SS)(C,D)、TRH(E,F)陽性線維終末。生後4日。ヘテロ接合体(+/-)でみられる陽性反応(A,C,E,矢印)はホモ結合体(-/-)ではすべて失われている(B,D,F)。V:第三脳室。スケールバーは200μm。

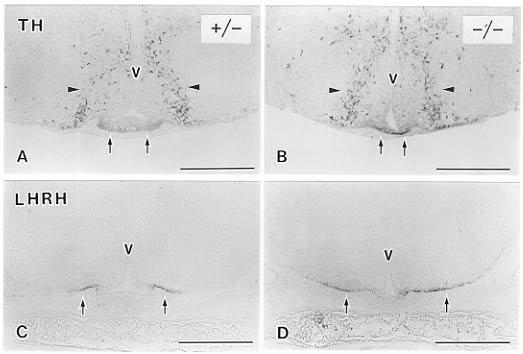
図4 Brn-2欠損マウスの内側底部視床下部におけるチロシン水酸化酵素(TH)(A,B)とLHRH(C,D)に対する免疫陽性反応。生後4日。ヘテロ(+/-)でみられる弓状核のTH陽性細胞体(A,矢頭)と正中隆起の陽性線維終末(A,C,矢印)ホモ(-/-)でも存在する(B,D)。V:第三脳室。スケールバーは200μm。

以上の免疫組織化学的な解析結果は、Brn-2の欠損がマウスの視床下部一下垂体系に存在する、様々な神経ペプチドを含むニューロン系に特異的な変化を引き起こしたことを意味している。
神経分泌ニューロン(neurosecretory neuron)は脳内で視床下部だけに存在するきわめて特殊なニューロンである。それらは神経細胞でありながら、正中隆起外層と下垂体後葉内にネットワークを作る有窓毛細血管の周囲腔に軸索を終末し、各種の神経ペプチドや伝達物質をホルモンとして血液中に放出する(表2)。この現象を神経分泌(neurosecretion)、また、血管内に放出される伝達物質を神経ホルモン(neurohormone)と呼んでいる。
表2 視床下部神経分泌ニューロンの特徴
| 神経ホルモン | 線維終末 | 細胞体 | 標的細胞 | reference |
| LHRH | 正中隆起外層 | 視索前野 | LH・FSH細胞 | Kawano, Daikoku, 1981 18) |
| TRH | 正中隆起外層 | 室傍核小細胞区 | TSH細胞 | Kawano et al, 1991 22) |
| ソマトスタチン | 正中隆起外層 | 室周囲部 | GH細胞 | Kawano et al, 1988a 20) |
| CRF | 正中隆起外層 | 室傍核小細胞区 | ACTH細胞 | Kawano et al, 1988b 21) |
| GRF | 正中隆起外層 | 弓状核 | GH細胞 | Daikoku et al, 1986 6) |
| ドーパミン | 正中隆起外層 | 弓状核 | PRL細胞 | Kawano et al, 1987 19) |
| バソプレッシン | 下垂体後葉 | 室傍核大細胞区、視索上核 | 腎臓 | Shelock et al, 1975 32) |
| オキシトシン | 下垂体後葉 | 室傍核大細胞区、視索上核 | 子宮、乳腺 | Shelock et al, 1975 32) |
| ドーパミン | 下垂体中葉 | 室周囲部 | MSH細胞 | Kawano et al, 1987 19) |
神経分泌ニューロンには大きく分けて二種類のものが存在する。第一のものは下垂体後葉に投射するところから、視床下部一下垂体後葉系ニューロン(hypothalamo-neurohypophysial neuron)と名付けられ、また細胞体の直径が20~30μmあるところから、大型神経分泌ニューロン(magnocellular neurosecretory neuron)とも言われている。また、これらのニューロンの存在は今から40年以上も前にアルデヒドフクシン染色により明らかにされていた2)ことから、古典的神経分泌系(classical neurosecretory system)とも呼ばれてきた。これらのニューロンは神経ペプチドであるバソプレッシンとオキシトシンを合成し、後葉内の毛細血管内に放出する。ラットやマウスでは、視床下部一下垂体後葉系ニューロンの細胞体は室傍核の大細胞区、視索上核およびいくつかの副核(accessary nuclei)に存在し32)、室傍核からの軸索は視床下部の外側を迂回した後、視交叉の外側上方で視索上核からの軸索と合流し、正中隆起部内層を経由して下垂体後葉に達する35)。
今回検索を行ったBrn-2欠損マウスでは、視床下部一下垂体後葉系のどのレベルでもバソプレッシン陽性反応は消失していた。もう一種の後葉ホルモンであるオキシトシンはバソプレッシンとは別のニューロンで産生されるが、オキシトシンは新生仔でも免疫組織化学的に検出し難いため、オキシトシンニューロンがホモ接合体で欠失しているか否かの確認ができなかった。しかし、ニッスル染色では室傍核と視索上核の細胞体がほぼ完全に消失し、下垂体後葉も著しく萎縮していることから、Brn-2欠損マウスでは2種類の後葉系ニューロンがともに失われていると結論された。なお、視床下部には後葉系ニューロンとは別に、視交叉上核にもバソプレッシンニューロンが存在し、生体リズムの調節に関係することが知られている35)が、視交叉上核にはBrn-2の発現はなく、かつ、この部位のバソプレッシンニューロンはBrn-2欠損マウスでも失われることはなかった。
視床下部に存在するもう1種の神経分泌ニューロンは正中隆起部に投射し、その外層にある下垂体門脈の一次毛細血管周囲腔に終末を形成するところから、隆起-漏斗系ニューロン(tubero-infundibular neuron)と呼ばれる。これらのニューロンは、TRH,LHRH、ソマトスタチン、CRF,growth hormone-releasing factor(GRF)などの神経ペプチドやモノアミンであるドーパミンを合成、放出し、各種の下垂体前葉細胞の機能調節を司る(表2)。これらのペプチド性神経ホルモンの構造は1969年から1985年までに次々に明らかにされ、それらを産生するニューロンの局在や線維投射路が各ペプチドに対する特異抗体を用いた免疫組織化学により精力的に調べられている36)(表2)。
今回、Brn-2欠損マウスでは、正中隆起外層のTRH、ソマトスタチン、CRFをそれぞれ含む陽性線維終末が消失していた。これらの線維終末は齧歯類では、室傍核の小細胞区(TRHとCRF)と第三脳室周囲部(ソマトスタチン)の細胞体に由来する20-22)。これに対し、正中隆起外層の線維終末の内、Brn-2欠損マウスでも存在したLHRHは視索前野18)に、ドーパミン合成酵素であるTHは弓状核19)にそれぞれ由来する(表2)。弓状核のGRFニューロンも正中隆起外層に投射するが、この時期こは免疫組織化学的にGRFを検出することはできなかった。しかしながら、Brn-2欠損マウスにおいても、弓状核の腹側部にはTH陽性細胞体が検出され、成熟動物ではこのニューロンは同時にGRFを含み、正中隆起に投与することから6)、弓状核のGRFニューロンはBrn-2欠損マウスでも存在すると結論された。
以上の結果から、Brn-2欠損マウスで失われたペプチド含有ニューロンの細胞体は室傍核の大細胞区と小細胞区、視索上核、および室周囲部に存在することがわかった(図5)。成熟ラットで、これらの部位にはいずれもBrn-2の強い発現がみられることから24)、おそらくBrn-2の欠損は直接これらのニューロンの生存を不可能にしたと思われる。なお、第三脳室周囲部に存在するニューロンでも、ソマトスタチンニューロンはBrn-2欠損マウスで消失するのに対し、TH陽性ニューロン19)はBrn-2欠損マウスでも消失しなかった。このニューロンは神経分泌ニューロンではないが、ドーパミンを産生し、下垂体中葉のmelanocyte-stimulating hormone(MSH)含有細胞とシナプス様の終末を形成する、規床下部一下垂体系のニューロンの一つである(表2、図5)。今回の結果では、このドーパミンニューロンだけでなく、正中隆起外層に投射する弓状核のドーパミンニューロンや、Brn-2の発現が報告されている中脳黒質など、脳内のカテコールアミン含有ニューロンに変化はみられなかった。なお、ショウジョウバエのPOUドメイン蛋白であるCflaはモノアミン合成酵素の一つであるドーパ脱炭酸酵素のプロモーターに結合することが知られている16)。
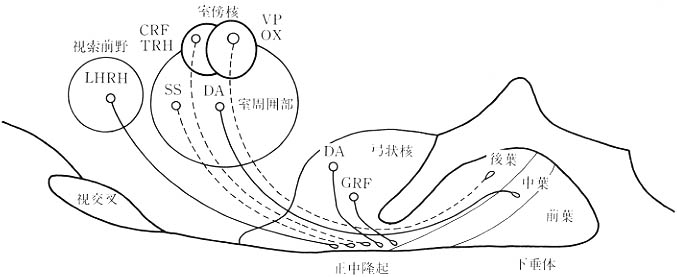
図5 Brn-2欠損マウスにおける視床下部神経分泌ニューロン系。室傍核大細胞区のバソプレッシン(VP)とオキシトシン(OX)、室傍核小細胞区のCRFとTRH、室周囲部のソマトスタチン(SS)を含むニューロン(白抜き、点線)が欠失する。ドーパミン(DA)、luteinizing hormone-releasing hormone (LHRH), growth hormone-releasing factor(GRF)を含む視床下部-下垂体系のニューロンは(実線)はBrn-2欠損マウスにおいても存在する。
脳内には、視床下部の他にもBrn-2を発現する部位が多くあるが、Brn-2欠損マウスにおいては、それらの部位のニューロンには大きな異常は認められず、少なくとも新生仔までは正常に発生するようであった。その理由は今のところ不明であるが、遺伝子欠損の影響がもう少し成長してからでないと現れないのか、あるいは、これまでの遺伝子夕一ゲティングの多くの例について言われているように、類似分子による代償作用(redundancy)があるのかもしれない。とくに、POU転写因子は相互にホモダイマーあるいはヘテロダイマーを形成して作用する可能性も示されており38)、さらに、Brn-2の場合には、同じPOUドメイン蛋白のclass IIIに属するBrn-1, Brn-4など構造類似性が高く、しかも脳内の発現パターンがよく似た分子が知られているので、これらの類似分子が失われたBrn-2の機能を肩代わりする可能性も考えられる。

今回の結果を解析する上で重要な間題は、Brn-2欠損マウスにおいて、視床下部の神経分泌ニューロンが発生初期の段階から分化しないのか、それとも発生の過程で細胞死に至るのかということである。しかし、そのことを知るためには、発生過程の神経分泌ニューロンを同定できるマーカーを用いて、それらのニューロンの初期の発生過程を調べる必要がある。
齧歯類ではバソプレッシン、あるいは後葉ホルモンの前駆体蛋白のC端ペプチドであるニューロフィジンは、他の神経分泌ニューロンに含まれるペプチドより早く検出されることがわかっている3)。マウスでは、バソプレッシンは胎生14日45)、ニューロフィジンは胎生13日34)より検出され、それらの陽性細胞の形態と局在より、後葉系ニューロンは最終定着部位に到達する以前にすでにバソプレッシンの合成を開始することが示された。しかしながら、[3H]標識のthymidineを用いた実験により、マウスの後葉系ニューロンはすでに胎生10~12日に第三脳室に面した神経上皮層で最終分裂を終えることが報告されている17,26,33)。したがって、神経ホルモンをマーカーとする限り、後葉系ニューロンの最初期の発生過程を追跡することは困難である。
そこで、われわれは、カルシウム結合蛋白の一種であるspot35 42)を後葉系ニューロンの初期のマーカーとして用いた。spot35は、最初、成熟ラット小脳より単離され42),カルシウム結合能43)、アミノ酸配列44)、および、組織学的局在37)などでcalbindin D-28k蛋白と非常に良く似ていることが報告されている。胎生17日マウスの視床下部の連続切片を抗バソプレッシンと抗spot35で免疫染色し、その局在を比較すると、calbindin D-28kと同様7)、spot35は細胞体と軸索の両方のレベルで後葉系ニューロンに強く発現していた(図6)。
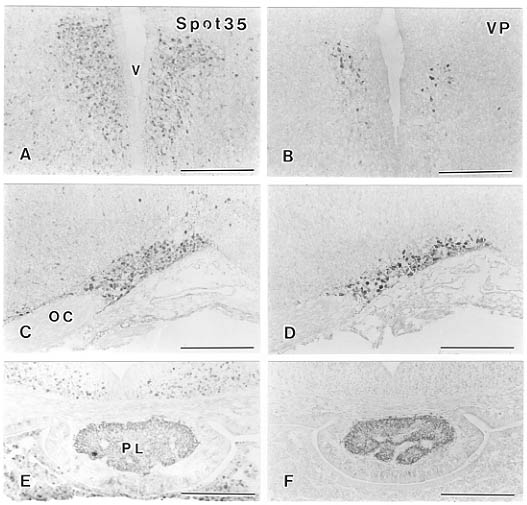
図6 胎生17日正常マウス視床下部におけるspot35陽性ニューロン(A,C,E)とバソプレッシン陽性ニューロン(B,D,F)の局在。spot35陽性細胞体はバソプレッシン(VP)細胞体が存在する室傍核(A)と視索上核(C)に、またspot35陽性線維はバソプレッシン線維が存在する下垂体後葉(PL,E)に検出される。OC:視交叉、V:第三脳室。スケールバーは200μm。
発生初期のマウス視床下部では、spot35免疫陽性反応は将来の室傍核一視索上核のレベルで胎生11日より検出された。その後、抗spot35を用いて後葉系ニューロンの挙動を追った結果、胎生10~12日に最終分裂を終えた後葉系ニューロンは胎生12日から14日にかけて外側に移動し、胎生16日までに大部分の細胞が室傍核と視索上核に定着することが明らかにされた(図7)。
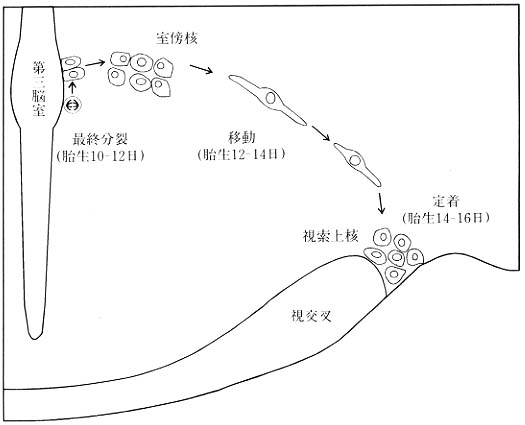
図7 視床下部-下垂体後葉系ニューロンの発生と移動様式。マウスでは、視床下部-下垂体後葉ニューロンは第三脳室に面した細胞上皮層で胎生10~12日に最終分裂を終え、胎生12~16日に定着して視索上核を形成する。
ラットでは、後葉系ニューロンは第三脳室に面した神経上皮で最終分裂を終え、その後、脳室面より遠ざかるように移動し、視索上核を形成することが[3H]標識thymidineを用いて報告されている1)が、今回抗spot35を用いたことにより、マウスでもほぼ同様の発生過程が示された。
そこで、後葉系ニューロンが盛んに移動している胎生13日に視索上核付近のspot35陽性細胞を観察すると、その形態はこれまで大脳皮質や小脳の発生過程で報告された移動中のニユーロン29, 30, 46)と同じく、双極性で、いわゆるleading processとtrailing processと思われる2本の突起をのばしながら移動していた(図8A)。同じ部位で発生初期のニューロンの移動に関係すると言われている細胞外基質分子の一つであるテネイシン4)の局在を調べると、移動の方向に一致して長い突起状の反応が見られ(図8B)、われわれがこれまで報告した小脳のプルキニエ細胞46)や中脳のドーパミンニューロン23)の移動と同様、テネイシンを発現する放射状グリアが後葉系ニューロンの移動に関係する可能性を示している。
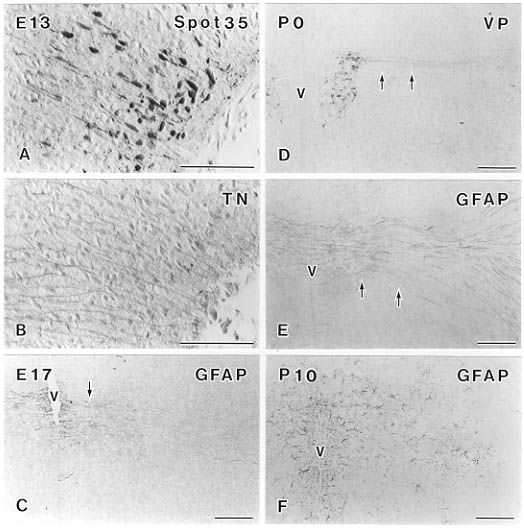
図8 正常マウスにおける視床下部-下垂体後葉系ニューロンの発生過程。胎生13日マウス前部視床下部におけるspot35(A)とテネイシン(TH)(B)の免疫陽性反応。Spot35陽性の後葉系ニューロン(A)はテネイシン陽性の放射状の突起(B)に沿って移動する。胎生17には放射状の突起はGFAPに陽性となる(C,矢印)が、その走行はGFAP陽性の突起と一致する(E,矢印)。生後10日になると、放射状グリアは消失し、多数のGFAP陽性のアストロサイトが出現する(F)。V:第三脳室。スケールバーは200μm。
テネイシンは発生初期の脳に一過性に発現することが報告されているが5)、視床下部でもテネイシンの発現は後葉系ニューロンの移動の時期と一致して一過性で、胎生15日を過ぎると、特異的な反応は認め難くなった。しかしながら、放射状グリアそのものはこの部位で存在し続け、胎生末期より、アストロサイトのマーカーであるGFAPに陽性となる(図8C)。
室傍核のバソプレッシンニューロンはマウスでは視索上核のものと同じく、胎生10~12日に最終分裂を終えるが、その発達は遅く、胎生末期になってようやくバソプレッシン陽性反応が急激に増加する45)。前述のように、室傍核から下垂体後葉に投射するバソプレッシンニューロンの軸索は、視床下部の外側部を迂回することが知られているが、新生仔になる頃から、室傍核から外側に伸びる軸索が明瞭に見えるようになる(図8D)。これまで、この軸索経路の形成機序については不明であったが、今回、この線維路の形成時期に一致してGFAP陽性の放射状グリアの突起が存在することが明らかになった(図8E)。GFAP陽性の放射状グリアはこの時期、視床下部の他の部位にはみられず、この線維路の形成が終わる生後5日目以降、その放射状の突起は不明瞭になった。生後10日には、この部位に多数のGFAP陽性のアストロサイトが出現し、放射状グリアがアストロサイトヘと変化したものと思われた(図8F)。このような、部位および時期特異的な関係から考えると、バソプレッシンニューロンの軸索伸長はGFAP陽性の放射状グリアによってガイドされるのであろう。
以上の結果をまとめると、胎生の10~12日に生まれたspot35陽性の後葉系ニューロンはテネイシンを発現する放射状グリアの突起に沿って外側に移動し視索上核を形成する。その後、室傍核のバソプレッシンニューロンは胎生末期よりGFAPを発現した放射状グリアの突起に沿って軸索突起を伸長させると考えられた(図9)。
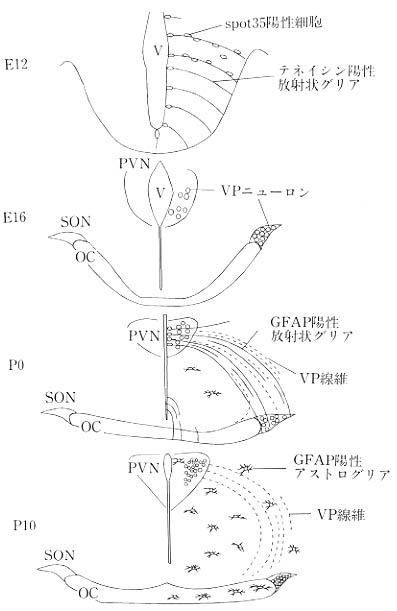
図9 視床下部-下垂体後葉系ニューロンと放射状グリアの発生過程のまとめ。胎生12日では、spot35陽性細胞はテネイシン陽性の放射状グリアの突起に沿って外側に移動し、胎生16日には、室傍核(PVN)と視索上核(SON)に定着する。出生直後では、室傍核からのバソプレッシン線維はGFAP陽性の放射状グリアの突起に沿って伸長する。生後10日になると、放射状グリアは消失し、バソプレッシン線維だけが残る。OC:視交叉、V:第三脳室。
後葉系ニューロンとともに、Brn-2欠損マウスで消失した、CRF,TRH、ソマトスタチンを含む隆起一漏斗系ニューロンの発生機序については、現在までまったく報告されていない。しかしながら、後葉系ニューロンと同様、神経分泌を行い、毛細血管基底膜に終末すること、あるいはこれらのニューロンの投射経路が先に示したバソプレッシンニューロンとほぼ同じであること27)を考慮すると、隆起一漏斗系ニューロンの発生も、バソプレッシンニューロンと共通の機序による可能性がある。

Brn-2を始めとするPOU classIIIに属する遺伝子は胎生初期のラット胎仔で脳および脊髄の脳室に面した神経上皮層に強い発現がみられる。神経上皮層では、未分化な細胞が分裂を繰り返し、ニューロンやグリアなどの神経系の細胞を生み出している。後葉系ニューロンは前部視床下部のダイアモンド型を呈する第三脳室の神経上皮より生じると報告されている1)。レトロウイルスを用いた研究により、神経上皮の同一の前駆細胞から生じたニューロンと放射状グリアは部位的に密接な関係を持って定着することが示されているので10,11)、後葉系ニューロンの移動に関係するテネイシン陽性の放射状グリア、またバソプレッシンニューロンの軸索伸長に関係するGFAP陽性の放射状グリアもまた、バソプレッシンニューロンとほぼ同じ部位から生じるものと推測される。
藤井と浜田9)は胚性腫瘍細胞由来のP19細胞株を用いて、Brn-2がニューロンの発生と分化に関係する可能性を示した。P19細胞は未分化な状態では分裂を繰り返しているが、その凝集細胞塊にレチノイン酸を加えるとニューロンとグリアに分化する、多分化能を持った細胞株である。彼らは、POU転写因子のうちOct-3が未分化なP19細胞に発現し、またBrn-2が神経系細胞へ分化する際に発現することを見出した。この時にあらかじめBrn-2のアンチセンスRNAが発現するようにしておくとP19細胞の神経系細胞への分化が阻害されることから、Brn-2はP19細胞が神経系細胞へ分化する際に必要であると結論された。発生初期の脳においても、Brn-2は末分化な神経上皮に発現するので、Brn-2がニューロンの分化に関与する可能性は大いにあり得る。そこで、神経分泌ニューロンの消失が上に述べた発生過程のどの時期に起こっているかを、胎生期の野生型、ヘテロおよび、ホモ接合体マウスの視床下部で調べた。
Brn-2欠損マウスでは胎生期においても、バソプレッシン免疫陽性ニューロンは一切検出できなかった。正常マウスでは室傍核と視索上核のバソプレッシン免疫陽性細胞体、および下垂体後葉のバソプレッシン免疫陽性線維終末は胎生14日に最初に出現する。したがって、神経分泌ニューロンの消失は胎生14日より早い時期であると考えられた。
そこで、前述のように、胎生11日から視床下部一下垂体後葉系ニューロンに検出できるカルシウム結合タンパクであるspot35を特異的マーカーとして調べたところ、胎生12日のホモ接合体マウスではspot35陽性細胞は検出されるものの、野生型やヘテロに比べ、少数かつ、移動中の細胞に特徴的な双極性の突起も明瞭でなく、明らかに異常な細胞像を示していた(図10B,D)。そして、胎生14日になると、spot35に強陽性を示す細胞は前部視床下部にはもはや確認できなかった(図10F)。したがって、Brn-2欠損動物では、後葉系ニューロンは胎生12日から14日にかけて、移動中に死んでいくと考えられた。
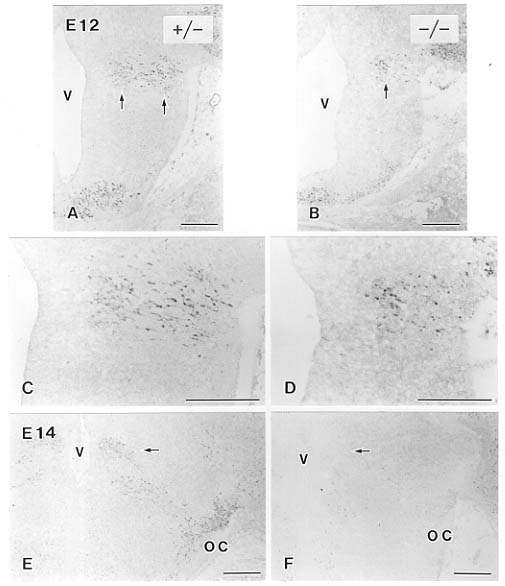
図10 Brn-2欠損マウス視床下部におけるspot35陽性反応。胎生12日のヘテロ接合体(+/-,A)では移動中のspot35陽性細胞(矢印)が多数みられるのに対し、ホモ接合体(-/-,B)ではその数が少ない(B,矢印)。C,D:A,Bの拡大。双極性に突起を伸ばした細胞はヘテロ接合体で顕著である(C)。胎生14日のヘテロ接合体(E)ではspot35陽性細胞が室傍核(矢印)と視索上核に定着しているが、ホモ接合体(F)では陽性細胞はまったくみられない。OC:視交叉、V:第三脳室。スケールバーは200μm。
さらに、Brn-2の欠損がこの部位でのグリア細胞の発生過程に与える影響を調べるため、Brn-2欠損動物の胎生12~14日の視床下部をテネイシンで、また、胎生末期から出生直後の視床下部をGFAPで免疫染色したが、どちらの場合も放射状グリアは正常動物と同様に存在していた。したがって、Brn-2欠損動物ではニューロンが特異的に欠失し、グリアの発生には影響しないと結論された。
以上の結果から、Brn-2は視床下部の神経分泌ニューロンの発生初期において、なにか重要な生存に必須な遺伝子の発現に関係すると思われた。その遺伝子は神経分泌ニューロンの分化に関係すると言うより、むしろ、これらのニューロンの移動や成長などに重要であると考えられた。Brn-2欠損動物では移動中のニューロンにspot35の発現が認められたため、少なくともspot35の発現にBrn-2は必須ではないとおもわれるが、それ以上のところは明らかでない。
Brn-2の発現は発生初期の脳内で神経上皮層に広くみられ、その後の成熟過程で、室傍核や視索上核など特定の部位へ移行するようになる。これまでの知見と今回の遺伝子ターゲッティングの結果を考え合わせると、Brn-2は視床下部神経分泌ニューロンが生まれる以前の神経上皮でニューロンとグリア細胞の分化に、移動中の細胞でニューロンの成長過程に、そして成熟したニューロンにおいて神経ペプチドの合成にと、様々な役割を果たしている可能性が示された。おそらく、Brn-2をはじめとするPOU転写調節因子は特定の細胞系譜のニューロンの発生過程を通じて、多様な機能スペクトラムを有する多機能分子として存在しているのだろう。

脳内にはそれぞれ特定のphenotypeを示す膨大な数のニューロンがひしめき合って存在している。それはさながら人種の坩堝にも譬えられそうであるが、人口過密な都市の群衆とは異なり、個々のニューロンは互いに秩序だった神経路を形成し、シナプス緒合によって結ばれ、協調して脳の高次神経機能を遂行している。さらに比喩を広げれば、脳内の細胞間コミュニケーションを仲介する伝達物質や接着因子、成長因子などの細胞間活性物質はさしずめ、人間社会における言語や文字に相当するのだろう。今回紹介したBrn-2を始めとするPOUドメイン蛋白などの各種の転写調節因子群は、これらの細胞間活性物質の発現を調節することにより、脳の形態形成と機能の維持に重要な働きをしていると考えられる。現在残されている大きな間題は、これまで脳の研究の難渋さを象徴してきた、ニューロンや神経回路の多様性、複雑性の機構が、各種転写調節因子による遺伝子発現のカスケードによって説明できるかということにある。さらに研究が進展し、われわれが『脳内で話されている分子の言語』の意味を理解できるようになったとき、脳の形成機序の本質的な解明が始まるといえるだろう。
抗spot35抗体を供与して下さった、新潟大学脳研究所の高橋康夫先生に深謝致します。

1)Altman J, Bayer SA : Development of the diencephalon in the rat. II. Correlation of the embryonic development of the hypothalamus with the time of origin of its neurons. J Comp Neurol 182 : 973-994, 1978
2)Bargmann W, Scharrer E : The site of origin of the hormones of the posterior pituitary. Am Scientist 39 : 255-259, 1951
3)Boer GJ, Buijs RM, Swaab DF, De Vries GJ : Vasopressin and the developing rat brain. Peptides 1 : 203-209, 1980
4)Chuong C-M, Crossin KL, Edelman GM : Sequen-tial expression and differential function of multiple adhesion molecules during the formation of cerebellar cortical layers. J Cell Biol 104 : 331-342, 1987
5)Crossin KL, Prieto AL, Hoffman S, Jones FS, Friedlander DR : Expression of adhesion molecules and the establishment of boundaries during embryonic and neural development. Exp Neurol 109 : 6-18, 1989
6)Daikoku S, Kawano H, Noguchi M, Nakanishi J, Tokuzen M, Chihara K, Nagatsu I : GRF neurons in the rat hypothalamus. Brain Res 399 : 250-261, 1986
7)Enderlin S, Norman AW, Celio MR : Ontogeny of the calcium binding protein calbindin D-28k in the rat nervous system. Anat Embryol 177 : 15-28, 1987
8)Finney M, Ruvkum G : The unc-86 gene product couples cell lineage and cell identity in C. elegans. Cell 63 : 895-905, 1990
9)Fujii H, Hamada H : A CNS-specific POU transcription factor, Brn-2, is required for establishing mammalian neural cell lineages. Neuron 11 : 1197-1206, 1993
10)Gray GE. Sanes JR : Lineage of radial glia in the chicken optic tectum. Development 114 : 271-283, 1992
11)Halliday AL, Cepko CL : Generation and migration of cells in the developing striatum. Neuron 9 : 15-26, 1992
12) Harada A, Oguchi K, Okabe S, Kuno J, Terada S, Ohshima T, Sato-Yoshitake R, Takei Y, Noda T, Hirokawa N : Altered microtubule organization in small-calibre axons of mice lacking tau protein. Nature 369 : 488-491, 1994
13) He X, Treacy MN, Simmons DM, Ingraham HA, Swanson LW, Rosenfeld MG : Expression of a large family of POU-domain regulatory genes in mammalian brain development. Nature 340 : 35-42, 1989
14) He X, Gerrero R, Simmons DM, Park RE, Lin CR, Swanson LW, Rosenfeld MG : Tst-1, a Member of the POU domain gene family, binds the promoter of the gene encoding the cell surface adhesion molecule Po. Mol Cell Biol 11 : 1739-1744, 1991
15) Ingraham HA, Flynn SE, Voss JW, Albert VR, Kapiloff MS, Wilson L, Rosenfeld MG : A tissue specific transcription factor containing a homeodomain specifies a pituitary phenotype. Cell 55 : 519-529, 1988
16) Johnson WA, Hirsch J : Binding of a drosophila POU-domain protein to a sequence element regulating gene expression in specific dopaminergic neurons. Nature 343 : 467-470, 1990
17) Kalim MA, Sloper JC : Histogenesis of the supraoptic and paraventricular neurosecretory cells of the mouse hypothalamus. J Anat 130 : 341-347, 1980
18) Kawano H, Daikoku S : Immunohistochemical demonstration of LHRH neurons and their pathways in rat hypothalamus. Neuroendocrinology 32 179-186, 1981
19) Kawano H, Daikoku S : Functional topography of the rat hypothalamic dopamine neuron systems. Retrograde tracing and immunohistochemical study. J Comp Neurol 265 : 242-253, 1987
20) Kawano H, Daikoku S : Sommatostatin-containing neuron system in the rat hypothalamus. Retrograde tracing and immunohistochemical studies. J Comp Neurol 271 : 293-299, 1988a
21) Kawano H, Daikoku S, Shibasaki T : CRF-containing neuron system in the rat hypothalamus. Retrograde tracing and immunohistochemical studies. J Comp Neurol 272 : 260-268, 1988b
22) Kawano H, Tsuruo Y, Bando H, Daikoku S : Hypophysiotrophic TRH-producing neurons identified by combining immunohistochemistry for pro -TRH and retrograde tracing. J Comp Neurol 307 : 351-358, 1991
23) Kawano H, Ohyama K, Kawamura K, Nagatsu I : Migration of dopaminergic neurons in the embryonic mesencephalon of mice. Dev Brain Res 1995 in press
24) Li P, 'He X. Gerrero MR, Mok M, Aggarwal A, Rosenfeld MG : Spacing and orientation of bipartite DNA-binding motifs as potential functional determinants for POU domain factors. Gen Dev 7 : 2483-2496, 1993
25) Mathis JM, Simmons DM, He X, Swanson LW, Rosenfeld MG : Brain 4 : a novel mammalian POU domain transcription factor exhibiting restricted brain-specific expression. EMBO J 11 : 2551-2561, 1992
26) Okamura H, Fukui K, Koyama E, Tsutou HLO, Tsutou T, Terubayashi H, Fujisawa H, Ibata Y : Time of vasopressin neuron origin in the mouse hypothalamus : examination by combined technique of Immunocytochemistry and [3H] thymidine autoradiography. Dev Brain Res 9 : 223-226, 1983
27) Palkovits M : Neuropeptides in the median eminence : their sources and destinations. Peptides 3 : 299-303, 1982
28) Pueles L, Rubenstein LR : Expression patterns of homeobox and other putative regulatory genes in the embryonic mouse forebrain suggest a neuromeric organization. TINS 16 : 472-479, 1993
29) Rakic P : Neuron-glia relationship during granule cell migration in developing cerebellar cortex. A Golgi and electronmicroscopic study in Macacus rhesus. J Comp Neurol 141 : 283-312, 1971
30) Rakic P : Mode of cell migration to the superficial layers of fetal monkey neocortex. J Comp Neurol 145 : 61-84, 1972
31) Schdler HR : Octamania : The POU factors in murine development. Trends Gen 7 : 323-328, 1991
32) Sherlock DA. Field PM, Raisman G : Retrograde transport of horseradish peroxidase in the magnocellular neurosecretory system of the rat. Brain Res 88 : 403-414, 1975
33) Shimada M, Nakamura T : Time of neuron origin in mouse hypothalamic nuclei. Exp Neurol 41 : 163-173, 1973
34) Silverman AJ, Goldstein R, Gadde CA : The ontogenesis of neurophysincontaining neurons in the mouse hypothalamus. Peptides I : 27-44, 1980
35) Sofroniew MV : Vasopressin, oxytocin and their related neurophysins. Handbook of Chemical Neuroanatomy 4 : 93-165, 1985
36) Swanson LW : The hypothalamus. In Handbook of Chemical Neuroanatomy, Vol 5, ed by Björklund A, Hokfelt T, Swanson LW. Elsevier, Amsterdam, 1992, pp 1-124
37)Takahashi-Iwanaga H, Kondo H, Yamakuni Y, Takahashi Y : An immunohistochemical study on the ontogeny of cells immunoreactive for spot 35 protein, a novel Purkinje cell-specific protein, in the rat cerebellum. Dev Brain Res 29 : 225-231, 1986
38) Tracy MN, Rosenfeld MG : Expression of a family of POU-domain protein regulatory genes during development of the central nervous system. Annu Rev Neurosci 15 : 139-165, 1992
39) Tsuchida T, Ensini M, Morton SB, Baldassare M, Edlund T, Jessell TM, Pfaff SL : Topographic organization of embryonic motor neurons defined by expression of LIM homeobox genes. Cell 79 : 957-970, 1994
40) Voss JW, Rosenfeld MG : Anterior pituitary development:short tales from dwarf mice. Cell 70:527-530, 1992
41) Wegner M, Drolet DW, Rosenfeld MG : POU-domain proteins : structure and function of developmental regulators. Curr Opin Cell Biol 5 : 488-498, 1993
42) Yamakuni Y, Usui H, Iwanaga Y, Kondo H, Odani S, Takahashi Y : Isolation and immunohistochemical localization of a cerebellar protein. Neurosci Lett 45 : 235-240, 1984
43) Yamakuni T, Araki K, Takahashi Y : The developmental changes of mRNA Ievels for a cerebellar protein (spot 35 protein)in rat brains. FEBS Lett 188 : 127-130, 1985
44) Yamakuni T, Kuwano R, Odani S, Miki N, Yamaguchi K. Takahashi Y : Molecular cloning of CDNA to mRNA for a cerebellar spot 35 protein. J Neurochem 48 : 1590-1596, 1987
45) Yamashita T, Kawamoto K, Kawashima S : Fetal and postnatal development of arginine vasopressin-immunoreactive neurons in the mouse. Zool Sci 5 : 1019-1032, 1988
46) Yuasa S, Kawamura K, Ono K, Yamakuni Y, Takahashi Y : Development and migration of Purkinje cells in the mouse cerebellar primordium. Anat Embryol 184 : 195-212, 1991

Development of mouse hypothalamic neurosecretory neurons and Brn-2, a POU transcription factor
Hitoshi Kawanol). Shigeyasu Nakai2). Koki Kawamural). Tetsuo Noda2)
from
l) Depariment of Anatomy, School of Medicine, Keio University, 35 Shinano-machi, Shinjuku-ku. Tokyo 160. Japan.
2) Department of Cell Biology. Cancer Institute, 1-37-1 Kami-ikebukuro, Toshima-ku. Tokyo 1 70, Japan.
The POU gene family is a large group of transcription factors sharing bipartite DNA-binding motifs, referred to as the POU-specific domain and the POU homeodomain. They have been shown to serve as developmental transactivators of genes that define and maintain specific cell phenotypes. Brn-2 is a member of POU transcription factors and is expressed in the nervous system in a region-specific manner. Brn-2-deficient mice were created by homologous recombination and their phenotype was analysed. A11 homozygous mice died in a few days after birth no histological abnormalities were detected in peripheral organs. Histological examination of the central nervous system of neonatal homozygotes revealed severe defects in the hypothalamo-hypophysial neuroendocrine system. By immunohistochemistry, vasopressin neurons in the paraventricular and supraoptic nuclei, as well as TRH and CRF neurons in the paraventricular nucleus, and somatostatin neurons in the periventricular area were not detected in the homozygote hypothalamus. In the embryonic development, hypothalamic magnocellular neurons immunoreactive for spot 35, a calcium-binding protein, were detected from embryonic day 11 (E11) in the wild-type. In Brn-2 deficient embryos, these neurons were gradually eliminated between E12 and E14 during the migration.
Since the paraventricular and supraoptic nuclei specifically express Brn-2 mRNA signals in normal animals, Brn-2 is likely to transactivate the genes prerequisite to survival of certain hypothalamic neurosecretory neurons in the early developmental stage.
(Received : May 22, 1995)

神経進歩(医学書院)・39巻5号・1995年10月より転載