
齧歯類小脳の神経移植による再構築(Reconstruction of the rodent cerebellum by means of neural transplantation)
-神経発生生物学的アプローチ-
川村 光毅

1.成体小脳組織の可塑的性質-移植片(donor)由来細胞の宿主(host)組織への移動(図1)
2.発達中の小脳組織におけるPj細胞の移動と接着分子の発現(図2)
4.発癌遺伝子導入により不死化(immortalize)した未分化神経上皮細胞の小脳内移植(図4)

哺乳類の中枢神経組織は従来、再生修復能力がないと考えられてきた。しかし、最近になって、損傷を受けた成体脳内に幼若神経組織を移植すると、細胞移動、突起伸展、シナプス形成が起こることが示され、特定条件下では成体脳組織にも再生能力が発現することが明らかとなった。再生過程においては、正常発生過程と多くの共通した現象が認められ、再生修復の促進には、発生過程で発現する種々の神経栄養因子、細胞接着因子が重要な役割を演じていることが推測される。筆者らは、齧歯類の成体小脳内に胎生期小脳組織を移植し、移植組織内でのプルキンエ細胞の分化・成長と宿主内への移動の過程における上記のような諸因子の発現について検討した。その結果、正常発生過程において細胞移動の際に発現する細胞接着因子tanascinが、移植組織から宿主内へのプルキンエ細胞の移動過程の際にも発現することが認められた。また、移植組織内におけるプルキンエ細胞の分化・成長過程において、正常発生過程と同様に、神経成長因子の受容体が一過性に発現するとともに、移植組織内において、神経栄養因子の一つであるbrain-derived
neurotrophic factor(BDNF)の遺伝子発現が認められた。このような所見から、神経発生過程において発現する神経成長栄養因子が成体中枢神経組織の再構築過程にも関与することが示唆された。
また、発癌遺伝子(SV40T抗原遺伝子の温度感受性変異体)の導入により不死化(immortalize)した神経上皮細胞(V-細胞)を均一な細胞集団からなる未分化神経細胞のモデルとして移植実験に用いた。そして、in
vitroでは一定条件下で分化能を発揮するこの細胞株が、移植後に宿主の脳内で分化・成長し、組織再構築に関わることを明らかにした。
今後、さらに損傷を受けた中枢神経組織の修復過程を促進するために栄養因子、分化誘導因子の発現を制御する手段を開発することにより、新しい治療法をめざす基礎的研究を進めていきたい。

1. 成体小脳組織の可塑的性質-移植片(donor)由来細胞の宿主(host)組織への移動(図1)
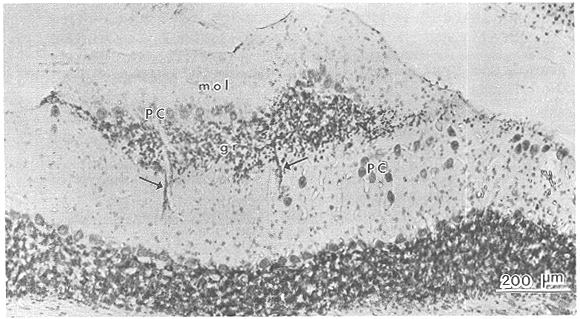
図1 hostラット小脳の表層に重なるように生着したE15,移植後6か月のdonorラット小脳組織
分子層(mol),プルキンエ細胞層(PC),顆粒細胞層(gr)を形成する移植組織から,プルキンエ細胞と顆粒細胞がhost分子層に移動した像が認められる.Nissl染色標本.(文献1による)
正常成体ラットの小脳に胎生14日の小脳原基の組織小片を移植すると、donor由来のプルキンエ(Pj)細胞がhost分子層内へ移動(migrate)することが観察された1)。Pj細胞が変性、脱落したPcdミュータントマウス(Purkinje
cell degeneration mouse)の小脳内においてもdonor Pj細胞が移動することが報告されているが2)、上記の所見よりPj細胞の脱落がみられない正常動物においても、hostの組織を破壊することなくdonorの神経細胞がhost内に移動することが明らかとなった。このような正常成体小脳内におけるPj細胞の移動は単に組織構成の欠陥や不完全さを補填するというメカニズムだけでは説明できず、神経組織のもつ可塑性の発現という観点から、この問題をとらえてみたいと思う。
光学顕微鏡的観察により、donorのPj細胞と顆粒細胞がともに血管壁に沿って存在する像が観察された。donor由来の血管はhostの血管とモザイクを形成するといわれているが3)、これらの血管が移植神経細胞のhost組織への移動をガイドする要因の一つとなっていると考えられる。この部位を電子顕微鏡的に観察すると、移動中の細胞と血管内皮細胞との間にperivascular
astrocyteが介在することが認められ、donor由来のPj細胞の移動には、グリアに依存した要因も関与するものと思われる。このような、すでに完成した脳組織内に外来性の細胞が移動しうる状態が誘起される現象には、どのような物質的基盤が隠されているのであろうか?

2.発達中の小脳組織におけるPj細胞の移動と接着分子の発現(図2)
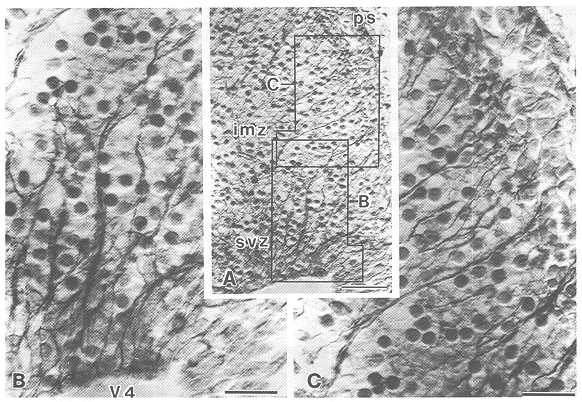
図2 抗テネイシン抗体で免疫染色したE14マウス小脳の矢状断切片の写真
放射状繊維は脳室領域から皮質表層まで広がっており(A),一部が拡大されてる(BとC).微分干渉顕微鏡.imz:
intermediate zone, svz: subventricular zone, ps: pial surface, V4:第4脳室,スケール:Aでは50μm,BとCでは20μm.(文献4による)
第4脳室に面した未分化神経上皮細胞中に存在するPj細胞前駆細胞が最終分裂(胎生11-13日、E11-13)の後、小脳原基のなかを背側に向かって移動し、Pj細胞に分化・発達する。このPj細胞の移動する過程を調べてみると、移動経路に一致して脳室壁から原始皮質の表層までradial
glia(放射状神経膠細胞)の突起が伸展しており、幼若プルキンエ細胞の移動はこの突起との接触によって誘導されると考えられる。そして、このradial
gliaの突起上には、ニューロンとグリアとの間の細胞接着因子であるテネイシン(tenascin,
TN)が発現していることが免疫組織化学的に認められた4)。
この接着因子TNは、中枢神経系において幼若なグリアによって産生される。そして、J1、cytotactinと同一かあるいは相同性が非常に高く、6本の腕をもった構造を示している。この分子内には、細胞接着活性を有するfibronection
type III(FN)domainと細胞接着阻害活性を有するepidermal growth
factor(EGF)domainが存在し、FN domainは腕の末端部分に局在する5)。TNの発現はPj細胞の移動が活発な小脳原基に認められ、成体小脳では免疫組織化学的には非常に弱い発現しか認められない。このような観点から、radial
gliaの突起上に発現したTNは、Pj細胞の移動におけるcontact guidanceに関与していることが推測される。また、電気泳動-Western
blot法によりTNの発現様式を調べた結果、小脳原基において220kDと205kDの二つの分子種が認められたが、成体小脳では205kDの分子種は認められなかった。このことから、胎生期小脳に特異的に発現する205kDの分子種がPj細胞の移動に関係している可能性が考えられる。
なお、E15-E16マウスで幼若型Pj細胞の移動が活発に起こっているが、この時期のPj細胞とradial
gliaとの接触に注目して電顕的に調べてみると、neuroblastの細胞膜の陥凹やcoated
vesicleのような、細胞膜のリサイクリング(recycling)に関連した像が観察された(未発表)。このような所見から、幼若なニューロンとグリアの突起との間に、細胞膜の接着、融合とサイクリングを介した物質の移動と情報伝達が起こっていることが示唆された。

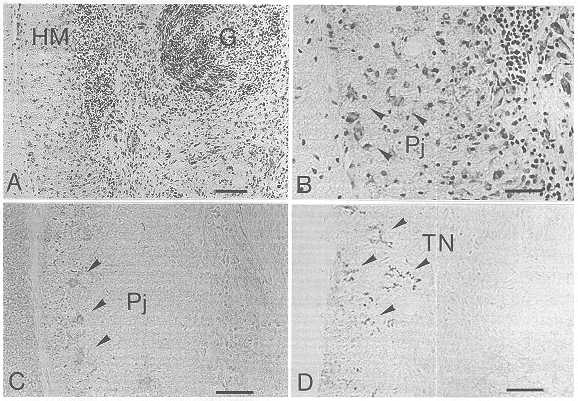
図3 成体ラット小脳にE14ラット小脳原基を移植して2週間後に観察された移植部位付近の顕微鏡像
A:移植細胞(G)がhost小脳実質内に生着している.Nissl染色標本.
B,C,D:host分子層を中心に拡大した部位の連続組織切片像.B:Nissl標本.C:抗spot35抗体による染色標本.D:抗tenasin抗体による染色標本.HM:host分子層,Pj:プルキンエ細胞,TN:テネイシン陽性の産物,スケール:Aでは100μm,B,C,Dでは50μm.
神経組織損傷後の修復・再構築の際にみられる現象と神経発生過程において認められる現象との間に、物質的基盤の類似性、より具体的にいえば、微細環境を規定する分子群の発現における類似性はないだろうか?この問題をPj細胞の移動という現象に的を絞って、正常脳における発生の時期と移植脳における組織再構築の際にみられる細胞移動との間で、接着因子や細胞外基質の発現について検討してみた。
胎生期小脳のおけるPj細胞の移動は、上記のようにradial gliaの突起に接して誘導され、この突起上にneuron-glia間の細胞接着に関与するTN分子の発現が認められたが、成体ラット小脳内に小脳原基を移植した際にも、移植組織内ならびに移植Pj細胞の移動経路と定着部位に細胞接着因子TNの発現が認められた。また、免疫電顕的観察によっても、移植組織と宿主組織との境界部にTN免疫陽性の、gliaの突起と考えられる構造が認められた。移植Pj細胞はTNのneuron-glia間の接着活性により、胎生期と同様の機構で宿主内を移動したことが推測された。また、本来、胎生期に強く発現し成体小脳組織には発現しないTNが、移植組織周辺の成体宿主組織に発現する現象は、幼若な移植組織により成体組織に誘導された一種の幼若化現象と解釈することができよう。この所見は遺伝子の発現があらかじめ定められたプログラムに従って、正しい時期に、正しい部位に一過性に生起する「発生」の事象と、一旦この段階を通過し、遺伝子発現の状態としては、潜伏していたものが幼若期の状態に再活性化されたとみなされうる「再生」の事象との間にある共通点を示唆するのもである。
損傷を受けた中枢神経組織に胎生脳組織を移植して宿主組織の再構築をはかる上で、移植組織の分化・成長および移植組織からの突起伸展を促進することは、シナプス形成による機能回復のための重要な決定因子である。神経発生過程においては、種々の神経成長栄養因子が発現して、神経芽細胞の分化・成長の促進に関与している6)。神経組織の再構築過程においてみられる現象は、神経発生過程と多くの共通点を有するという観点から、筆者らはラット成体小脳内へ胎生小脳を移植する実験系において、生着したPj細胞の分化・成長の過程に、神経栄養因子がどのように関与するかを形態学的に検討した。
発達過程にあるPj細胞の表面には、nerve growth factor(NCF)に対する低親和性受容体の発現が一過性に認められる。成体ラット小脳内に移植された小脳原基内においても、Pj細胞の分化・成長が認められるとともに、移植組織内のPj細胞の細胞膜に限局してNGF受容体の発現が認められた。また、in
situ hybridization法により、発達過程にある小脳組織内に神経栄養因子の一つであるbrain-derived
neurotrophic factor(BDNF)の発現が認められるとともに、移植された小脳原基内にもBDNFの遺伝子発現が認められた。
以上の所見により、細胞接着因子、神経栄養因子とその受容体の発現は、神経細胞の移動・分化・成長に重要な役割を果たすとともに、中枢神経系の再生・修復過程の促進にも関わると考えられ、移植組織による宿主成体組織の可塑性発現の誘導機構に深く関わるものと推測される。

4.発癌遺伝子導入により不死化(immortalize)した未分化神経上皮細胞の小脳内移植(図4)
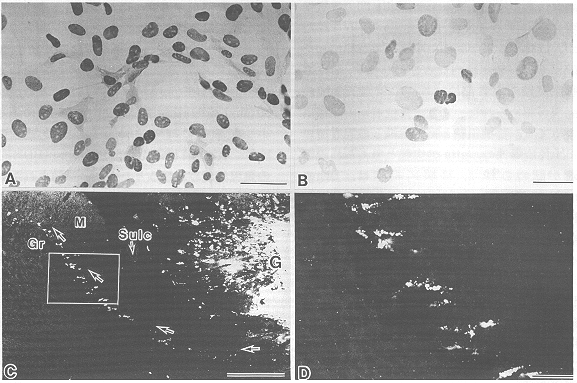
図4 A,B:永久増殖化細胞核V-1細胞の,SV40T抗原にタイする抗体による免疫染色像
A:33℃培養条件下でほとんどすべての細胞の核にSV40T抗原の発現が認められる.
B:39℃培養条件下でSV40T抗原遺伝子が不活化され,ほとんどすべての細胞は免疫反応陰性となる.
C:成体マウス小脳内に移植されたV-1細胞集団(G)から矢印の方向に移動した細胞がプルキンエ細胞層のすぐ内側に2~3層の列を作って配列する.
D:Cの枠の部分の拡大図.M:分子層,Gr:顆粒細胞層,Sulc:小脳溝,スケール:A,B,Dでは50μm,Cでは250μm.
in vitroで増殖可能な、均一な細胞集団で、しかも一定の条件下で神経細胞に分化しうる細胞群を損傷を受けた脳内に移植することによって、神経組織の再構築の過程を組織片の移植実験に比べてより単純な系で研究することができる。筆者らは、発癌遺伝子の一つであるSV40T抗原遺伝子の温度感受性変異体tsA58をレトロウイルスを用いてマウス間脳に由来する未分化神経上皮細胞の初代培養細胞に導入し、不死化ないし永久増殖化(immortalizad)細胞株(V-1)を作製した。このV-1細胞は33℃では活発に増殖するが、39℃(培養器またはhostとして用いたマウスの体温)では大部の細胞でSV40T抗原遺伝子が不活性化され、一部の細胞は神経系細胞に分化する7)。この細胞株を小脳内に移植して移植細胞の移動と分化について観察した。
培養V-1細胞をcarbocyanine系蛍光色素DiIにより標識し、この標識された細胞を小脳実質内に移植した。2週間後に移植部位の組織切片を観察すると、生着した細胞集団が認められ、一部の細胞はneurofilament免疫陽性の突起を伸展していた。また、他の一部の集団は隣接する小葉へ移動し、Pj細胞のすぐ外層で宿主の分子層内に2~3層の層状をなして配列した。移動細胞の一部はBergmann
gliaの突起と接していた。また移動経路上の移植細胞はleading processを伸ばし、血管の基底膜と接している像が電顕的に観察された(未発表)。
以上、donor細胞の移動と特徴的な層状配列には、血管基底膜やグリア細胞突起との接触による誘導が関与していると考えられる。また、腎実質内にこのV-1細胞が移植されてもニューロンへの分化は認められず(未発表)、ニューロンへの分化にはhost神経組織由来の分化誘導因子が関与していると思われる。

齧歯類の小脳を研究の場として、哺乳動物の中枢神経系のもつ可塑性の問題について筆者らの研究室で得られたデータを紹介し、考察を加えた。高等動物の脳は修復不可能の硬い配線構造物であるとみなす因襲的な固定観念がここに覆された。今後、神経発生生物学的観点から、中枢神経系における細胞の分裂、移動、分化さらには組織の再構築や修復の問題について、接着因子、分化誘導因子、成長栄養因子など微小環境要因の関与を含めて研究を進めていきたい。
(謝辞:慶應義塾および内藤記念科学振興財団からの研究助成に感謝いたします。)

1) Kawamura K, Nanami T, Kikuchi Y et al:Grafted granule and Purkinje cells can
migrate into the mature cerebellum of normal adult rats. Exp Brain Res, 70:477-484, 1988
2) Sotelo C and Alvarado-Mallart RM:Growth and differentiation of cerebellar
suspensions transplanted into the adult cerebellum of mice with heredodegenerative ataxia.
Proc Natl Acad Sci USA, 83:1135-1139, 1986
3) Zhou C-F, Lindsay RM, Lawrence JM et al:Extent of survival and vascularization of
adult superior cervical sympathethic or nodose ganglia transplanted into the septal nuclei
or choroid fissure of adult rats. Neuroscience, 17:808-813, 1986
4) Yuasa S, Kawamura K, Ono K, et al:Development and migration of Purkinje cells in
the mouse cerebellar primordium. Anat Embryol, 184:195-212, 1991
5) Erickson HP and Bourdon MA:Tenascin:an extracellular matrix protein prominent in
specializad embryonic tissues and tumors. Annu Rev Cell Biol, 5:71-92, 1989
6) Thoenen H:The changing scene of neurotrophic factors. TINS, 14:165-170, 1991
7) Yuasa S, Kawamura K, Tsurushima H et al:Neuronal differetiation of immortalizad
cell line V1 transplanted into the mouse brain. Neurosci Res, supplement 16:S79, 1991

(第95回 日本医学会シンポジウム、1992より)